题目内容
14.下列有关试剂的保存方法错误的是( )| A. | 氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氟酸盛装在细口玻璃瓶中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
分析 A.氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠;
B.钠易与水和氧气反应;
C.氢氟酸和二氧化硅反应生成四氟化硅;
D.氯水中的次氯酸见光易分解.
解答 解:A.氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中,故A正确;
B.钠易与水和氧气反应,所以要隔绝空气保存,钠的密度大于煤油的,且和煤油不反应,所以可用煤油保存,故B正确;
C.氢氟酸和二氧化硅反应生成四氟化硅,所以不能用玻璃瓶盛放氢氟酸,要用塑料瓶盛放,故C错误;
D.氯水中的次氯酸见光易分解而导致Cl2水变质,应于棕色试剂瓶避光保存,故D正确.
故选C.
点评 本题考查化学试剂的存放,题目难度不大,注意把握化学试剂的性质,选择正确的保存方法,试题贴近高考,针对性强,有利于激发学生的学习兴趣和学习积极性.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
5.已知A、B、C、D、E五种元素都是元素周期表中前四周期元素,原子序数依次增大,E的价电子排布式为3d104s1.A、B、C、D四种短周期元素在元素周期表中的相对位置如下表所示.
根据以上信息,回答下列问题:
(1)基态C原子含有5种能量不同的电子,其简单离子的电子排布式为1s22s22p6.
(2)DA2+离子的中心原子的杂化轨道类型是sp3,其立体构型为V形.
(3)A所在主族元素的氢化物中,沸点最低的是HCl(填化学式);第一电离能比较:B<C (填“>”、“<”、“=”).
(4)E单质的晶体堆积方式为面心立方密堆积,空间利用率为74%;C与D形成的化合物中化学键类型为共价键.
(5)E的氧化物E2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个E原子.若该晶体的密度为ρ g/cm3,则晶胞参数a=$\root{3}{\frac{1152}{ρ•{N}_{A}}}$cm (列出表达式即可).
| A | |||||||
| B | C | D |
(1)基态C原子含有5种能量不同的电子,其简单离子的电子排布式为1s22s22p6.
(2)DA2+离子的中心原子的杂化轨道类型是sp3,其立体构型为V形.
(3)A所在主族元素的氢化物中,沸点最低的是HCl(填化学式);第一电离能比较:B<C (填“>”、“<”、“=”).
(4)E单质的晶体堆积方式为面心立方密堆积,空间利用率为74%;C与D形成的化合物中化学键类型为共价键.
(5)E的氧化物E2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个E原子.若该晶体的密度为ρ g/cm3,则晶胞参数a=$\root{3}{\frac{1152}{ρ•{N}_{A}}}$cm (列出表达式即可).
19.如图所示的实验或操作中,能达到实验目的是( )
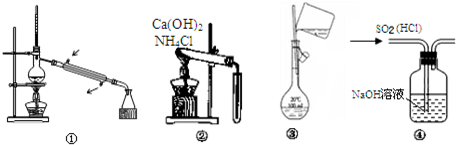

| A. | 图①常用于分离沸点不同且彼此互溶的液态混合物 | |
| B. | 图②可用于实验室制备并收集少量的NH3 | |
| C. | 图③表示的是实验室配制溶液转移过程 | |
| D. | 图④可用于除去SO2中的HCl气体 |
6.下列说法正确的是( )
| A. | 熔点:Na-K合金<Na<氯化钠 | |
| B. | 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 | |
| D. | 同一原子中,2p、3p、4p能级的轨道数依次增多 |
1.通常所说的三大材料是指金属材料、无机非金属材料和有机高分子材料.下述材料中全部属于金属材料的是( )
| A. | 玻璃、陶瓷、水泥 | B. | 塑料,合成纤维、橡胶 | ||
| C. | 青铜、碳素钢、硬铝 | D. | 玻璃钢、聚乙烯、超导陶瓷 |
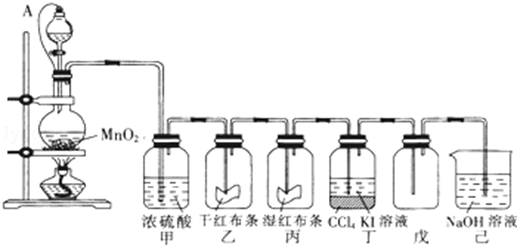
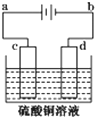 (1)电镀时,镀件与电源的负极连接.
(1)电镀时,镀件与电源的负极连接.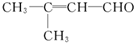 含氧官能团有醛基.
含氧官能团有醛基.