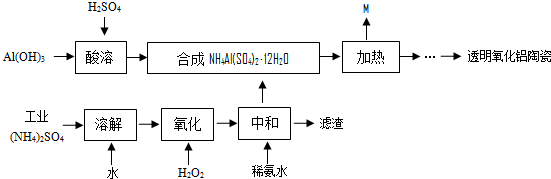
题目内容
16.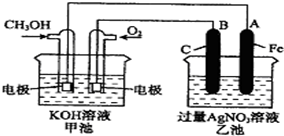 如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )
如图是一个化学过程的示意图,已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O则下列说法中不正确的是( )| A. | 甲池是燃料电池,其中通入氧气的一极是原电池的正极 | |
| B. | 乙池是电解池,铁电极是阴极,一段时间后会析出金属银 | |
| C. | 甲池是电解池,乙是原电池 | |
| D. | 甲池一段时间后溶液的pH值会变小 |
分析 根据反应方程式知,甲装置是燃料电池,通入甲醇的一极为负极,通入氧气的一极为正极;乙有外加电源,所以是电解池,石墨与原电池的正极相连,所以B石墨电极是阳极,Fe为阴极,阴极上银离子得电子生成Ag,结合反应方程式判断溶液的pH.
解答 解:A.甲装置是燃料电池,通入甲醇的一极为负极,通入氧气的一极为正极,故A正确;
B.Fe与原电池的负极相连,Fe为阴极,阴极上银离子得电子生成Ag,故B正确;
C.甲装置是燃料电池,乙有外加电源,是电解池,故C错误;
D.甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,反应消耗KOH,溶液的碱性减小,则pH减小,故D正确.
故选C.
点评 本题考查了原电池原理和电解池原理的应用,明确电极判断方法、电极反应的书写等是解题关键,侧重于考查学生的分析能力,题目难度不大.

练习册系列答案
相关题目
5.已知A、B、C、D、E五种元素都是元素周期表中前四周期元素,原子序数依次增大,E的价电子排布式为3d104s1.A、B、C、D四种短周期元素在元素周期表中的相对位置如下表所示.
根据以上信息,回答下列问题:
(1)基态C原子含有5种能量不同的电子,其简单离子的电子排布式为1s22s22p6.
(2)DA2+离子的中心原子的杂化轨道类型是sp3,其立体构型为V形.
(3)A所在主族元素的氢化物中,沸点最低的是HCl(填化学式);第一电离能比较:B<C (填“>”、“<”、“=”).
(4)E单质的晶体堆积方式为面心立方密堆积,空间利用率为74%;C与D形成的化合物中化学键类型为共价键.
(5)E的氧化物E2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个E原子.若该晶体的密度为ρ g/cm3,则晶胞参数a=$\root{3}{\frac{1152}{ρ•{N}_{A}}}$cm (列出表达式即可).
| A | |||||||
| B | C | D |
(1)基态C原子含有5种能量不同的电子,其简单离子的电子排布式为1s22s22p6.
(2)DA2+离子的中心原子的杂化轨道类型是sp3,其立体构型为V形.
(3)A所在主族元素的氢化物中,沸点最低的是HCl(填化学式);第一电离能比较:B<C (填“>”、“<”、“=”).
(4)E单质的晶体堆积方式为面心立方密堆积,空间利用率为74%;C与D形成的化合物中化学键类型为共价键.
(5)E的氧化物E2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个E原子.若该晶体的密度为ρ g/cm3,则晶胞参数a=$\root{3}{\frac{1152}{ρ•{N}_{A}}}$cm (列出表达式即可).
8.下列关于电解质分类的组合中,完全正确的是( )
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | HClO | HNO3 |
| 弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
| 非电解质 | Cl2 | CS2 | C2H5OH | SO2 |
| A. | A | B. | B | C. | C | D. | D |
6.下列说法正确的是( )
| A. | 熔点:Na-K合金<Na<氯化钠 | |
| B. | 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 | |
| D. | 同一原子中,2p、3p、4p能级的轨道数依次增多 |
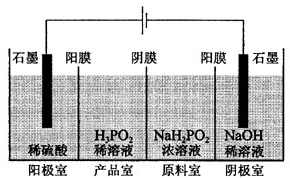 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题: Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答: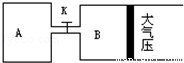
 器恢复原来反应前的体积,可采取的措施是____________________。
器恢复原来反应前的体积,可采取的措施是____________________。