题目内容
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述错误的是( )
| A、镭比钙的金属性更强 |
| B、碳酸镭易溶于水 |
| C、在化合物中呈+2价 |
| D、氢氧化镭是强碱 |
考点:同一主族内元素性质递变规律与原子结构的关系
专题:
分析:镭与Ca、Mg等元素位于周期表同一主族,性质具有相似性,原子最外层电子数为2,结合同主族元素性质的递变规律解答该题.
解答:
解:A.同主族元素从上到下元素的金属性逐渐增强,则镭比钙的金属性更强,故A正确;
B.Ca、Mg的碳酸盐都难溶于水,同主族元素的性质相似,所以碳酸镭难溶于水,故B错误;
C.镭原子最外层电子数为2,化合价为+2价,故C正确;
D.同主族元素从上到下元素的金属性逐渐增强,氢氧化镭为强碱,故D正确.
故选B.
B.Ca、Mg的碳酸盐都难溶于水,同主族元素的性质相似,所以碳酸镭难溶于水,故B错误;
C.镭原子最外层电子数为2,化合价为+2价,故C正确;
D.同主族元素从上到下元素的金属性逐渐增强,氢氧化镭为强碱,故D正确.
故选B.
点评:本题考查同主族元素的性质,题目难度不大,注意同主族元素的性质具有相似性和递变性.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )

| A、键角为120° |
| B、化学组成为SiO32- |
| C、Si原子采用sp2轨道杂化方式 |
| D、化学组成为SiO44- |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ?mol-1
②CH3OH(g)+
O2(g)═CO2(g)+2H2(g);△H=-192.9kJ?mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ?mol-1
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A、若用甲醇(CH3OH)为原料设计成燃料电池,则通入甲醇的电极为负极 | ||
B、 反应①中的能量变化如图所示 | ||
| C、CH3OH转变成H2的过程一定要吸收能量 | ||
D、根据②推知反应:CH3OH(l)+
|
下列变化中,不需要破坏化学键的是( )
| A、氯化氢溶于水 |
| B、加热氯酸钾使其分解 |
| C、碘升华 |
| D、氯化钠溶于水 |
目前人类已发现的非金属除稀有气体外共有16种,下列对这16种非金属元素的相关判断正确的是( )
①都是主族元素,最外层电子数都大于4
②常温下气体单质都是双原子分子
③最高正化合价与最低负化合价代数和为0的元素有3种
④氢化物在常温下都是气态
⑤能形成既含离子键又含共价键的化合物.
①都是主族元素,最外层电子数都大于4
②常温下气体单质都是双原子分子
③最高正化合价与最低负化合价代数和为0的元素有3种
④氢化物在常温下都是气态
⑤能形成既含离子键又含共价键的化合物.
| A、①②④ | B、②③⑤ |
| C、③⑤ | D、①④ |
下列说法正确的是( )
| A、离子化合物中可以含有共价键 |
| B、共价化合物中可以含有离子键 |
| C、当元素处于最高价态时一定具有强氧化性 |
| D、元素的性质呈周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 |
下列分子中,共价键的极性最强的是( )
| A、NH3 |
| B、H2S |
| C、CH4 |
| D、H2O |
设NA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量O:16)( )
| A、常温常压下,16g O3气体含有氧原子数为NA |
| B、标准状况下,44.8 L三氯甲烷含有的分子数为NA |
| C、1molFe与足量稀硝酸反应,转移的电子数为2NA |
| D、1L 0.1mol?L-1氨水中含有0.1NA个OH- |
不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量.下列说法正确的是( )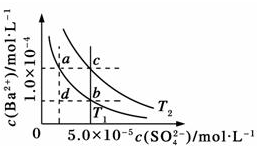

| A、T1>T2 |
| B、加入BaCl2固体,可使a点变成c点 |
| C、c点时,在T1、T2两个温度下均有固体析出 |
| D、a点和b点的Ksp相等 |