题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量O:16)( )
| A、常温常压下,16g O3气体含有氧原子数为NA |
| B、标准状况下,44.8 L三氯甲烷含有的分子数为NA |
| C、1molFe与足量稀硝酸反应,转移的电子数为2NA |
| D、1L 0.1mol?L-1氨水中含有0.1NA个OH- |
考点:阿伏加德罗常数
专题:
分析:A.16g臭氧分子中含有16g氧原子,含有1mol氧原子;
B.标准状况下,三氯甲烷的状态不是气体;
C.铁与足量稀硝酸反应生成硝酸铁,1mol铁完全反应失去3mol电子;
D.氨水为弱碱,一水合氨在溶液中部分电离出氢氧根离子.
B.标准状况下,三氯甲烷的状态不是气体;
C.铁与足量稀硝酸反应生成硝酸铁,1mol铁完全反应失去3mol电子;
D.氨水为弱碱,一水合氨在溶液中部分电离出氢氧根离子.
解答:
解:A.常温常压下,16g O3气体中含有16g 氧原子,含有氧原子的物质的量为1mol,含有氧原子数为NA,故A正确;
B.标况下三氯甲烷不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故B错误;
C.1mol铁与足量稀硝酸反应生成1mol硝酸铁,转移了3mol电子,转移的电子数为3NA,故C错误;
D.1L 0.1mol?L-1氨水中含有溶质一水合氨0.1mol,由于一水合氨为弱电解质,在溶液中只能部分电离出氢氧根离子,则该溶液中氢氧根离子浓度小于0.1mol,溶液中含有的氢氧根离子小于0.1NA,故D错误;
故选A.
B.标况下三氯甲烷不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故B错误;
C.1mol铁与足量稀硝酸反应生成1mol硝酸铁,转移了3mol电子,转移的电子数为3NA,故C错误;
D.1L 0.1mol?L-1氨水中含有溶质一水合氨0.1mol,由于一水合氨为弱电解质,在溶液中只能部分电离出氢氧根离子,则该溶液中氢氧根离子浓度小于0.1mol,溶液中含有的氢氧根离子小于0.1NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,还要注意弱电解质在溶液中部分电离的特点.

练习册系列答案
相关题目
下列根据反应原理设计的应用,不正确的是( )
| A、CO32-+H2O?HCO3-+OH 用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3+H+ 明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?x H2O↓+4HCl 用TiCl4制备TiO2 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述错误的是( )
| A、镭比钙的金属性更强 |
| B、碳酸镭易溶于水 |
| C、在化合物中呈+2价 |
| D、氢氧化镭是强碱 |
人类已知的化合物中,种数最多的是( )
| A、过渡元素形成的化合物 |
| B、第IIIA族元素形成的化合物 |
| C、第VIIA族元素形成的化合物 |
| D、第IVA族元素形成的化合物 |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: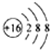 | ||
B、NH4Cl的电子式: | ||
C、原子核内有18个中子的氯原子:
| ||
D、NH3 的电子式: |
悬浊液、乳浊液、溶液和胶体都是( )
| A、稳定的液体 | B、透明的溶液 |
| C、混合物 | D、化合物 |
某溶液中含有如下离子组中的若干种:K+、Mg2+、Fe3+、Fe2+、CO32-、NO3-、SO42-、I-、SiO32-、Cl-且物质的量浓度相同.某同学欲探究该溶液的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到浅紫色火焰;
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色.
下列说法正确的是( )
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到浅紫色火焰;
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色.
下列说法正确的是( )
| A、原溶液中肯定不含Mg2+、SiO32- |
| B、步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- |
| C、原溶液由K+、Fe2+、NO3-、I-、SO42-五种离子组成 |
| D、原溶液中一定含有Mg2+、Cl- |



