题目内容
下列分子中,共价键的极性最强的是( )
| A、NH3 |
| B、H2S |
| C、CH4 |
| D、H2O |
考点:极性键和非极性键
专题:化学键与晶体结构
分析:一般来说,不同非金属元素之间形成极性共价键,两种元素的非金属性相差越大,则共价键的极性越大,以此来解答.
解答:
解:NH3、H2S、CH4、H2O中均含有非金属元素与H元素形成的极性共价键,元素的非金属性越强,与H元素形成的极性键的极性越强,非金属性O元素的最强,则H2O中共价键的极性最强;
故选D.
故选D.
点评:本题考查化学键,熟悉化学键的形成及分析化学键的一般规律即可解答,较简单.

练习册系列答案
相关题目
以下物质间的每步转化通过一步反应就能实现的是( )
| A、NaHCO3→Na2O→Na2CO3 |
| B、Fe→FeCl3→FeCl2 |
| C、Si→H2SiO3→Na2SiO3 |
| D、Al2O3→Al(OH)3→NaAlO2 |
通过复习总结,你认为下列对化学知识概括合理的组合是( )
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑤过氧化氢和液氮的分子中都有非极性共价键
⑥共价化合物中可能含有离子键
⑦非极性分子中一定含有非极性键.
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑤过氧化氢和液氮的分子中都有非极性共价键
⑥共价化合物中可能含有离子键
⑦非极性分子中一定含有非极性键.
| A、只有②④⑤ |
| B、只有②③⑥ |
| C、只有①③⑤ |
| D、只有④⑤⑦ |
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述错误的是( )
| A、镭比钙的金属性更强 |
| B、碳酸镭易溶于水 |
| C、在化合物中呈+2价 |
| D、氢氧化镭是强碱 |
元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )
| A、元素原子的核外电子排布呈周期性变化 |
| B、元素的原子半径呈周期性变化 |
| C、元素的化合价呈周期性变化 |
| D、元素的金属性、非金属性呈周期性变化 |
人类已知的化合物中,种数最多的是( )
| A、过渡元素形成的化合物 |
| B、第IIIA族元素形成的化合物 |
| C、第VIIA族元素形成的化合物 |
| D、第IVA族元素形成的化合物 |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图: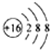 | ||
B、NH4Cl的电子式: | ||
C、原子核内有18个中子的氯原子:
| ||
D、NH3 的电子式: |
下列叙述正确的是( )
| A、向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 |
| B、向水玻璃中滴加盐酸制备硅酸 |
| C、用加热法除去Ca(OH)2固体中混有的NH4Cl固体 |
| D、SO2通入酸性KMnO4溶液检验其漂白性 |
