题目内容
不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量.下列说法正确的是( )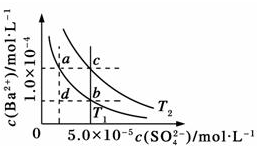

| A、T1>T2 |
| B、加入BaCl2固体,可使a点变成c点 |
| C、c点时,在T1、T2两个温度下均有固体析出 |
| D、a点和b点的Ksp相等 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A.根据温度对Ksp的影响分析;
B.加入BaCl2固体,c(Ba2)增大,c(SO42-+)减小;
C.根据Qc与Ksp相对大小判断;
D.Ksp是常数,只与温度有关.
B.加入BaCl2固体,c(Ba2)增大,c(SO42-+)减小;
C.根据Qc与Ksp相对大小判断;
D.Ksp是常数,只与温度有关.
解答:
解析:A.硫酸钡在水中溶解时吸收热量,温度越高,Ksp越大,在T2时硫酸钡的Ksp大,故T2>T1,故A错误.
B、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入BaCl2,会增大c(Ba2),平衡左移,c(SO42-+)应降低,所以不能使溶液由a点变到C点,故B错误;
C、在T1时C点表示Qc>Ksp,溶液饱和,有沉淀析出,在T2时C点表示Qc<Ksp,溶液不饱和,没有沉淀析出,故C错误;
D、Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D正确;
故选D.
B、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入BaCl2,会增大c(Ba2),平衡左移,c(SO42-+)应降低,所以不能使溶液由a点变到C点,故B错误;
C、在T1时C点表示Qc>Ksp,溶液饱和,有沉淀析出,在T2时C点表示Qc<Ksp,溶液不饱和,没有沉淀析出,故C错误;
D、Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D正确;
故选D.
点评:本题考查学生影响化学平衡移动的因素:温度、浓度等和Ksp的应用等,注意图象题的分析方法,固定变量法是常用的处理方式,难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述错误的是( )
| A、镭比钙的金属性更强 |
| B、碳酸镭易溶于水 |
| C、在化合物中呈+2价 |
| D、氢氧化镭是强碱 |
下列物质中酸性最强的是( )
| A、HClO4 |
| B、H2SO4 |
| C、H3PO4 |
| D、H2SiO4 |
下列叙述正确的是( )
| A、向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 |
| B、向水玻璃中滴加盐酸制备硅酸 |
| C、用加热法除去Ca(OH)2固体中混有的NH4Cl固体 |
| D、SO2通入酸性KMnO4溶液检验其漂白性 |
某溶液中含有如下离子组中的若干种:K+、Mg2+、Fe3+、Fe2+、CO32-、NO3-、SO42-、I-、SiO32-、Cl-且物质的量浓度相同.某同学欲探究该溶液的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到浅紫色火焰;
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色.
下列说法正确的是( )
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到浅紫色火焰;
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
Ⅲ.取Ⅱ反应后的溶液分置于两支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层出现紫红色.
下列说法正确的是( )
| A、原溶液中肯定不含Mg2+、SiO32- |
| B、步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- |
| C、原溶液由K+、Fe2+、NO3-、I-、SO42-五种离子组成 |
| D、原溶液中一定含有Mg2+、Cl- |




