题目内容
4.某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出):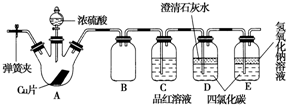
实验选用细铜片、98.3%硫酸、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品.铜片一端没入浓硫酸中.根据上述材料回答下列问题:
(1)D、E两容器中CCl4的作用是防止倒吸.
(2)加热过程中,随着反应的进行,A容器中有白色沉淀生成,你认为该沉淀物是CuSO4,分析可能的原因浓硫酸中含水少,生成的硫酸铜较多,浓硫酸的吸水作用,硫酸铜无法带结晶水析出,只能生成无水硫酸铜.
(3)对A容器中的浓硫酸和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀.你的猜想是SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,生成了Ca(HSO3)2溶液.设计实验验证你的猜想取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加盐酸检验SO2气体等方法).
(4)实验结束后,为了减少环境污染,排除各装置中的SO2,可采取的操作是打开A容器上的弹簧夹,通入空气,将装置中的SO2赶到E中,最后再向B中加入NaOH溶液,盖上塞子,振荡即可.
分析 (1)二氧化硫和强碱的反应十分剧烈,要注意防止倒吸现象的发生;
(2)铜和浓硫酸反应生成硫酸铜,加热的情况下,由于A容器中出现大量白色烟雾,导致溶剂减少,且浓硫酸具有吸水性,所以会析出白色固体硫酸铜;
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,说明产生SO2气体的速率快,但始终未见D试管中澄清石灰水出现浑浊或沉淀,这是由于SO2溶解度较大,立即生成了Ca(HSO3)2溶液的缘故.因此验证猜想的方法是取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加热、加盐酸检验SO2气体等方法);
(4)二氧化硫为酸性气体,可用浓氢氧化钠溶液吸收,减小对环境的污染.
解答 解:(1)二氧化硫和强碱的反应十分剧烈,可以采用四氯化碳的作用来达到防止倒吸现象的发生的目的,
故答案为:防止倒吸;
(2)铜和浓硫酸反应生成硫酸铜,加热的情况下,由于A容器中出现大量白色烟雾,导致溶剂减少,且浓硫酸具有吸水性,所以会析出白色固体硫酸铜,
故答案为:CuSO4;浓硫酸中含水少,生成的硫酸铜较多,浓硫酸的吸水作用,硫酸铜无法带结晶水析出,只能生成无水硫酸铜;
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,说明产生SO2气体的速率快,但始终未见D试管中澄清石灰水出现浑浊或沉淀,这是由于SO2溶解度较大,立即生成了Ca(HSO3)2溶液的缘故.因此验证猜想的方法是取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加热、加盐酸检验SO2气体等方法),
故答案为:SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,生成了Ca(HSO3)2溶液;取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加盐酸检验SO2气体等方法);
(4)打开三颈烧瓶的弹簧夹,充入空气把二氧化硫赶到盛有浓氢氧化钠溶液的烧杯中吸收,减小对环境的污染,
故答案为:打开A容器上的弹簧夹,通入空气,将装置中的SO2赶到E中,最后再向B中加入NaOH溶液,盖上塞子,振荡即可.
点评 本题考查了性质方案的设计,题目难度中等,注意掌握浓硫酸的化学性质及性质实验方案设计的方法,明确题中资料信息是解题关键,试题培养了学生的分析、理解能力及化学实验能力.

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | 同浓度的四种溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2溶液,c(NH4+)浓度的大小关系:②>④>③>① | |
| B. | 一定浓度的NaHS溶液中:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 若0.1 mol/L NH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1-10-5)mol/L | |
| D. | 现有四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水电离出的氢离子浓度大小关系为:②=④>③>① |
①酸性高锰酸钾 ②溴水 ③液溴 ④水.
| A. | 只有① | B. | 只有①② | C. | ①②③④ | D. | 只有②③ |
| A. | 要完成实验需称取10.6gNa2CO3•10H2O晶体 | |
| B. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线,会导致溶液浓度偏高 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |

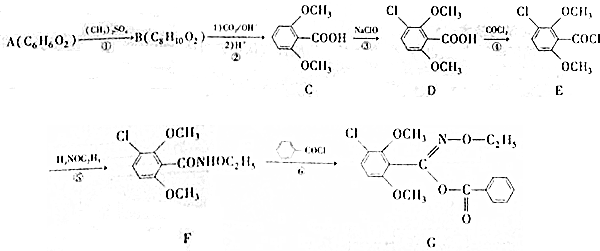
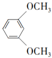 ;⑤的反应类型为取代反应.
;⑤的反应类型为取代反应.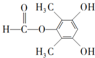 、
、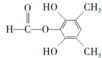 .
. 为原料制备
为原料制备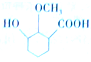 的合成路线
的合成路线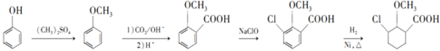
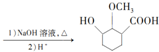
 已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).
已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).