题目内容
14.锂离子电池的应用很广,其正极材料可再生利用.某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等.充电时,该锂离子电池负极发生的反应为6C+xLi++xe-═LixC6.现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出).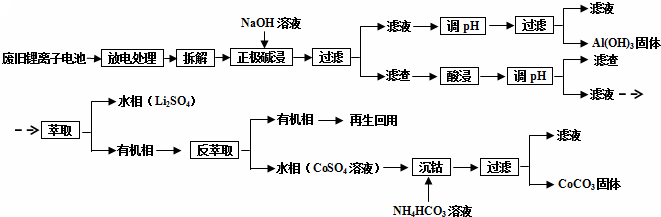
回答下列问题:
(1)LiCoO2中,Co元素的化合价为+3.
(2)写出“正极碱浸”中发生反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式2LiCoO2+H2O2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Li2SO4+2CoSO4+O2↑+4H2O,2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;可用盐酸代替H2SO4和H2O2的混合液,但缺点是有氯气生成、污染较大.
(4)写出“沉钴”过程中发生反应的化学方程式CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O.
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式Li1-xCoO2+LixC6=LiCoO2+6C.
分析 废旧锂离子电池放电处理拆解后正极用氢氧化钠溶液碱溶过滤得到滤液调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入硫酸,过氧化氢调节溶液PH过滤得到滤液加入萃取剂萃取分液得到水层为硫酸锂,有机层通过反萃取得到水层硫酸钴溶液加入碳酸氢铵溶液沉淀钴离子得到碳酸钴固体;
(1)根据化合物中,化合价的代数和为0判断;
(2)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;由题中信息知LiCoO2具有强氧化性,加入过氧化氢调节溶液PH;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀;
(5)放电时,Li1-xCoO2和LixC6发生氧化还原反应生成LiCoO2和C.
解答 解:废旧锂离子电池放电处理拆解后正极用氢氧化钠溶液碱溶过滤得到滤液调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入硫酸,过氧化氢调节溶液PH过滤得到滤液加入萃取剂萃取分液得到水层为硫酸锂,有机层通过反萃取得到水层硫酸钴溶液加入碳酸氢铵溶液沉淀钴离子得到碳酸钴固体;
(1)根据化合物中,化合价的代数和为0知,LiCoO2中,Co元素的化合价为+3价,故答案为:+3;
(2)正极中含有铝,铝易溶于强碱溶液生成AlO2-,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Li2SO4+2CoSO4+O2↑+4H2O,由题中信息知LiCoO2具有强氧化性,加入过氧化氢发生的反应为:2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;盐酸代替H2SO4和H2O2的混合液的缺点是有氯气生成、污染较大,
故答案为:2LiCoO2+H2O2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Li2SO4+2CoSO4+O2↑+4H2O,2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;有氯气生成、污染较大;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀、硫酸铵、二氧化碳和水,反应方程式为CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O;
(5)放电过程中,Li1-xCoO2和LixC6发生氧化还原反应生成LiCoO2和C,反应方程式为Li1-xCoO2+LixC6=LiCoO2+6C,
故答案为:Li1-xCoO2+LixC6=LiCoO2+6C.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | 将煤通过物理变化液化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、
投料比$\frac{n({H}_{2})}{n(CO)}$的变化曲线如图1所示.
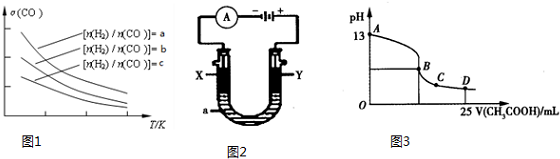
①a、b、c按从大到小的顺序排序为a>b>c.
②根据图象可以判断该反应为放热反应,理由是投料比相同,温度越高CO的转化率越低,平衡向左移动,推得该反应为放热反应.
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-.
①则负极的电极反应式为CO+2O2--2e-=CO32-.
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL 上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中 消耗一氧化碳的质量为2.8g.
| A. | 最高价氧化物对应水化物的酸性:W>Z>X | |
| B. | 化合物Q有强氧化性 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
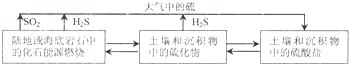
(1)已知:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
S(s)+O2(g)═SO2(g)△H=-297.04kJ.mol-1
写出H2S(g)与O2(g)反应产生S(s)和H2O(g)的热化学方程式2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-442.38kJ.mol-1.
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用离子方程式,从沉淀溶解平衡的角度表示由ZnS转变为CuS的过程ZnS(S)+Cu2+(aq)?Zn2+(aq)+CuS(S).
(3)某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至Ph=2,过滤后,将所得滤液蒸发浓缩,冷却结晶,过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
| 25℃ | 饱和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(开始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||
②在SnS、FeS共存的溶液中,若c(Sn2+)=1.0×10-9mol•L-1,则c(Fe2+)=6.3×10-2mol•L-1.
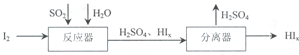
(4)SO2是大气污染物,若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.SO2还可以按下列流程制备化工原料硫酸,反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx.
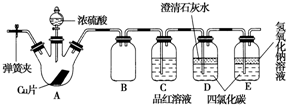
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: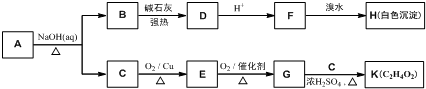

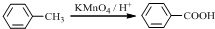
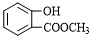 .
.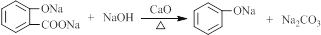 .
.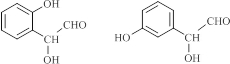 (写结构简式).
(写结构简式).