题目内容
15.西斗星(G)是一种常见农药,其合成路线流程图如下: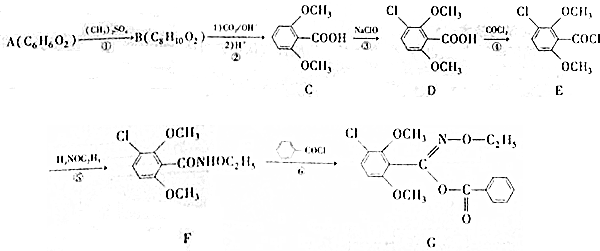
请回答下列问题:
(1)化合物A的名称为间苯二酚或1,3-苯二酚;化合物C中含氧官能团为羧基和醚键.(填名称)
(2)B的结构简式为
 ;⑤的反应类型为取代反应.
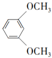
;⑤的反应类型为取代反应.(3)满足下列条件的C的同分异构体有6种;其中能发生水解反应的结构简式为
 、
、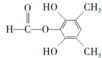 .
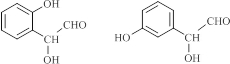
.Ⅰ.能发生银镜反应也能与FeCl3溶液发生显色反应.
Ⅱ.核磁共振氢谱有4组峰且峰面积之比为6:2:1:1.
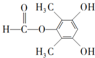
(4)依据西斗星的合成路线,写出以
 为原料制备
为原料制备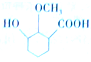 的合成路线
的合成路线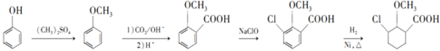
 (无机试剂可任选)
(无机试剂可任选)
分析 (1)(2)比较B的分子式和C的结构简式可知,B为 ,根据A的分子式及A转化成B的条件可知,A为
,根据A的分子式及A转化成B的条件可知,A为 ,A发生取代反应生成 B,比较E和F的结构简式可知⑤的反应类型;
,A发生取代反应生成 B,比较E和F的结构简式可知⑤的反应类型;
(3)根据条件Ⅰ.能发生银镜反应也能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,Ⅱ.核磁共振氢谱有4组峰且峰面积之比为6:2:1:1,结合C的结构简式可知C的同分异构体的种类;其中能发生水解反应的,说明有酯基,据此书写其结构简式;
(4)依据西斗星的合成路线,以 为原料制备
为原料制备 可以将
可以将 与硫酸甲酯反应生成甲苯醚,再发生类似西斗星的合成路线中的②和③反应,再与氢气加成后碱性水解、酸化可得
与硫酸甲酯反应生成甲苯醚,再发生类似西斗星的合成路线中的②和③反应,再与氢气加成后碱性水解、酸化可得 ,据此答题;
,据此答题;
解答 解:(1)根据A的分子式及A转化成B的条件可知,A为 ,A的名称为间苯二酚或1,3-苯二酚,根据C的结构简式可知,C中含氧官能团为羧基和醚键,
,A的名称为间苯二酚或1,3-苯二酚,根据C的结构简式可知,C中含氧官能团为羧基和醚键,
故答案为:间苯二酚或1,3-苯二酚;羧基和醚键;
(2)比较B的分子式和C的结构简式可知,B为 ,比较E和F的结构简式可知⑤的反应类型为取代反应,
,比较E和F的结构简式可知⑤的反应类型为取代反应,
故答案为: ;取代反应;
;取代反应;
(3)根据条件Ⅰ.能发生银镜反应也能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,Ⅱ.核磁共振氢谱有4组峰且峰面积之比为6:2:1:1,结合C的结构简式可知符合条件的同分异构体为 、
、 、
、 、
、 、
、 、
、 ,共6种,其中能发生水解反应的,说明有酯基,其结构简式为
,共6种,其中能发生水解反应的,说明有酯基,其结构简式为 、
、 ,
,
故答案为:6; 、
、 ;
;
;
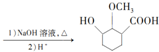
(4)依据西斗星的合成路线,以 为原料制备
为原料制备 可以将
可以将 与硫酸甲酯反应生成甲苯醚,再发生类似西斗星的合成路线中的②和③反应,再与氢气加成后碱性水解、酸化可得
与硫酸甲酯反应生成甲苯醚,再发生类似西斗星的合成路线中的②和③反应,再与氢气加成后碱性水解、酸化可得 ,其合成路线为
,其合成路线为
 ,
,
故答案为:
 .
.
点评 本题考查有机物的推断与合成,成分利用转化关系中有机物的进行进行分析解答,较好的考查学生的分析推理能力、获取信息能力、知识迁移运用能力,难度中等.

练习册系列答案
相关题目
3.含硫化合物在自然界中广泛存在,部分循环关系如下:
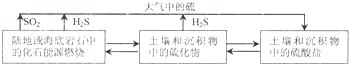
(1)已知:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
S(s)+O2(g)═SO2(g)△H=-297.04kJ.mol-1
写出H2S(g)与O2(g)反应产生S(s)和H2O(g)的热化学方程式2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-442.38kJ.mol-1.
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用离子方程式,从沉淀溶解平衡的角度表示由ZnS转变为CuS的过程ZnS(S)+Cu2+(aq)?Zn2+(aq)+CuS(S).
(3)某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至Ph=2,过滤后,将所得滤液蒸发浓缩,冷却结晶,过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
①通入H2S气体至饱和的目的是将溶液中的Sn2+转变为SnS而除去;用硫酸酸化至pH=2的目的是防止Fe2+转化为FeS沉淀.
②在SnS、FeS共存的溶液中,若c(Sn2+)=1.0×10-9mol•L-1,则c(Fe2+)=6.3×10-2mol•L-1.
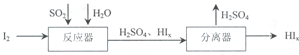
(4)SO2是大气污染物,若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.SO2还可以按下列流程制备化工原料硫酸,反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx.

(1)已知:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
S(s)+O2(g)═SO2(g)△H=-297.04kJ.mol-1
写出H2S(g)与O2(g)反应产生S(s)和H2O(g)的热化学方程式2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-442.38kJ.mol-1.
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用离子方程式,从沉淀溶解平衡的角度表示由ZnS转变为CuS的过程ZnS(S)+Cu2+(aq)?Zn2+(aq)+CuS(S).
(3)某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至Ph=2,过滤后,将所得滤液蒸发浓缩,冷却结晶,过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
| 25℃ | 饱和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(开始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||
②在SnS、FeS共存的溶液中,若c(Sn2+)=1.0×10-9mol•L-1,则c(Fe2+)=6.3×10-2mol•L-1.
(4)SO2是大气污染物,若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.SO2还可以按下列流程制备化工原料硫酸,反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx.

10.设NA为阿佛加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L空气中O2、N2分子数为NA | |
| B. | 0.1mol羟基中所含电子数目为NA | |
| C. | 钠与氧气反应时,每消耗4.6g钠时生成的阴离子数目为0.1NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数为0.2NA |
20.自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展.
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)=2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
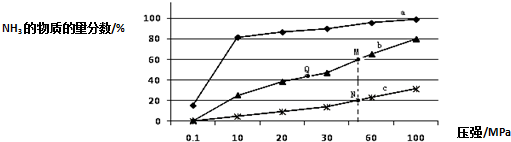
①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(1)下表列举了不同温度下大气固氮的部分平衡常数K值.
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
②2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是33.3%(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)=2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.

①曲线a对应的温度是200℃.
②关于工业合成氨的反应,下列叙述正确的是A(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=0.93(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是CO32-+CO2+H2O=2HCO3-.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
7.下列关于NaHCO3溶液的叙述正确的是( )
| A. | NaHCO3溶液显弱酸性 | |
| B. | 该溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |

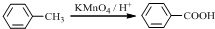
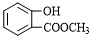 .
.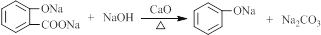 .
. (写结构简式).
(写结构简式).