题目内容
用价层电子互斥理论模型预测下列粒子的立体结构是三角锥形的是( )
| A、PCl3 |
| B、BeCl2 |
| C、NH4+ |
| D、SO3 |
考点:判断简单分子或离子的构型
专题:
分析:根据价层电子对互斥理论,粒子的立体结构是三角锥形,说明该离子的中心原子是SP3杂化,且有一对孤电子对,以此来解答.
解答:
解:A、PCl3中心原子P电子对数=3+
=4,中心原子是SP3杂化,且有一对孤电子对,粒子的立体结构是三角锥形,故A正确;
B、BeCl2中心原子Be电子对数=2+
=3,中心原子是SP2杂化,有一对孤电子对,粒子的立体结构是V型,故B错误;
C、NH4+中心原子N电子对数=4+
=4,中心原子是SP3杂化,没有一对孤电子对,粒子的立体结构是正四面体型,故C错误;
D、SO2中心原子S电子对数=2+
=3,中心原子是SP2杂化,有一对孤电子对,粒子的立体结构是V型,故D错误.
故选:A.
| 5-1×3 |
| 2 |
B、BeCl2中心原子Be电子对数=2+
| 4-1×2 |
| 2 |
C、NH4+中心原子N电子对数=4+
| 5-1-1×4 |
| 2 |
D、SO2中心原子S电子对数=2+
| 6-2×2 |
| 2 |
故选:A.
点评:本题考查了分子空间构型的判断,题目难度不大,注意把握离子和分子价层电子对数的判断方法.

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
在无色透明溶液中,不能大量共存的离子组是( )
| A、Cu2+、SO42- |
| B、K+、NO3- |
| C、OH-、Na+ |
| D、Ba2+、NO3- |
检验某极稀的溶液中是否含有N03-,正确的操作方法是( )
| A、加入铜屑和浓硫酸后加热 |
| B、加热浓缩后,再加浓硫酸铜片混合共热 |
| C、加热蒸干,再加强热 |
| D、加热蒸干后与浓硫酸.铜片混合共热 |
下列各组物质分离提纯的方法不正确的是( )
| A、用酒精作萃取剂提取碘水中的碘 |
| B、用分液的方法分离溴和四氯化碳 |
| C、用蒸馏的方法除去水中的Na+离子 |
| D、用过滤的方法除去水中的泥沙 |
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
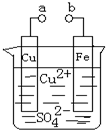

| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,溶液中的SO42-向铁电极移动,铜片上发生的反应为:Cu2++2e-=Cu |
| C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D、a和b分别连接直流电源正、负极,溶液中的Cu2+向铜电极移动 |