题目内容
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
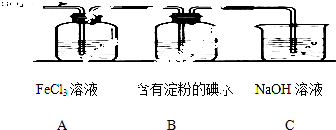
(1)装置C的作用是 .
(2)若要从FeSO4溶液获得FeSO4?7H2O晶体,必须进行的实验操作步骤: 、 、过滤、洗涤、自然干燥.
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请写出检验A烧杯中有Fe2+生成的操作方法 ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-.该做法 (填“合理”或“不合理”),理由是 .
(4)能表明I-的还原性弱于SO2的现象是 .

(1)装置C的作用是
(2)若要从FeSO4溶液获得FeSO4?7H2O晶体,必须进行的实验操作步骤:
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式
②请写出检验A烧杯中有Fe2+生成的操作方法
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-.该做法
(4)能表明I-的还原性弱于SO2的现象是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染;
(2)从FeSO4溶液获得FeSO4?7H2O晶体,进行蒸发浓缩,冷却结晶,过滤,洗涤、自然干燥就得到FeSO4?7H2O,回收硫酸亚铁;
(3)①根据装置A二氧化硫具有还原性,三价铁具有氧化性结合氧化还原反应书写离子方程式;
②一般检验有Fe2+生成先用KSCN溶液无现象,再用氯水氧化亚铁离子生产三价铁溶液变红来检验,但是现在溶液中还可能含有三价铁,所以不能用KSCN溶液和氯水来检验,选用高锰酸钾溶液利用高锰酸钾的强氧化性判断;
③亚硫酸根能与硝酸发生氧化还原反应生产硫酸根;
(4)B中蓝色褪去,说明二氧化硫和碘单质反应,依据氧化还原反应中还原剂的还原性大于还原产物分析.
(2)从FeSO4溶液获得FeSO4?7H2O晶体,进行蒸发浓缩,冷却结晶,过滤,洗涤、自然干燥就得到FeSO4?7H2O,回收硫酸亚铁;
(3)①根据装置A二氧化硫具有还原性,三价铁具有氧化性结合氧化还原反应书写离子方程式;
②一般检验有Fe2+生成先用KSCN溶液无现象,再用氯水氧化亚铁离子生产三价铁溶液变红来检验,但是现在溶液中还可能含有三价铁,所以不能用KSCN溶液和氯水来检验,选用高锰酸钾溶液利用高锰酸钾的强氧化性判断;
③亚硫酸根能与硝酸发生氧化还原反应生产硫酸根;
(4)B中蓝色褪去,说明二氧化硫和碘单质反应,依据氧化还原反应中还原剂的还原性大于还原产物分析.
解答:
解:(1)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,所以装置C的作用为:吸收SO2尾气,防止污染空气,
故答案为:除去多余的SO2,防止污染大气;
(2)蒸发蒸发浓缩、冷却结晶是从溶液中获得晶体常采用的方法,产生沉淀后通过过滤实现分离,故答案为:蒸发浓缩;冷却结晶;
(3)①因为二氧化硫具有还原性,三价铁具有氧化性,则二氧化硫与铁离子反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②一般检验有Fe2+生成先用KSCN溶液无现象,再用氯水氧化亚铁离子生产三价铁溶液变红来检验,但是现在溶液中还可能含有三价铁,所以不能用KSCN溶液和氯水来检验,选用高锰酸钾溶液,具体操作为:取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;故答案为:取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;
③亚硫酸根能与硝酸发生氧化还原反应生产硫酸根,所以不可证明反应生成了SO42-,该方法不合理,故答案为:不合理;硝酸具有氧化性,亚硫酸根可以被硝酸氧化成硫酸根离子;
(4)B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故答案为:B中蓝色褪去.
故答案为:除去多余的SO2,防止污染大气;
(2)蒸发蒸发浓缩、冷却结晶是从溶液中获得晶体常采用的方法,产生沉淀后通过过滤实现分离,故答案为:蒸发浓缩;冷却结晶;
(3)①因为二氧化硫具有还原性,三价铁具有氧化性,则二氧化硫与铁离子反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②一般检验有Fe2+生成先用KSCN溶液无现象,再用氯水氧化亚铁离子生产三价铁溶液变红来检验,但是现在溶液中还可能含有三价铁,所以不能用KSCN溶液和氯水来检验,选用高锰酸钾溶液,具体操作为:取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;故答案为:取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;
③亚硫酸根能与硝酸发生氧化还原反应生产硫酸根,所以不可证明反应生成了SO42-,该方法不合理,故答案为:不合理;硝酸具有氧化性,亚硫酸根可以被硝酸氧化成硫酸根离子;
(4)B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故答案为:B中蓝色褪去.
点评:本题考查了物质性质实验方案的设计,题目难度中等,试题涉及氧化还原方程式书写、氧化性还原性强弱比较、性质实验方案的设计与评价等知识,侧重学生分析能力和计算能力的考查,明确掌握二氧化硫的性质等知识为解答本题关键.

练习册系列答案
相关题目
将碘酒滴到切开的土豆片上,可观察到土豆片变蓝,说明土豆中含有( )
| A、油脂 | B、蛋白质 |
| C、淀粉 | D、纤维素 |
 实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是( )
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是( )| A、此实验表明氯水具有酸性、漂白性 |
| B、内环呈白色,外环呈红色或浅红 |
| C、内外环上颜色的差异表明氯水中含有H+、HClO 等粒子 |
| D、久置的氯水滴到蓝色石蕊试纸上,会出现与上述相同的现象 |
利用如图所示装置进行下列实验,能得出相应实验结论的是( )


| A、①浓盐酸,②MnO2③NaOH,实验结论:制氯气并吸收尾气 |
| B、①浓硫酸,②蔗糖,③溴水,实验结论:浓硫酸具有脱水性、氧化 |
| C、①稀盐酸,②Na2SO3,③Ba(NO3)2溶液,实验结论:SO2与可溶性钡盐均可生成白色沉淀 |
| D、①浓硝酸,②Na2CO3,③Na2SiO3溶液,实验结论:酸性:硝酸>碳酸>硅酸 |
用价层电子互斥理论模型预测下列粒子的立体结构是三角锥形的是( )
| A、PCl3 |
| B、BeCl2 |
| C、NH4+ |
| D、SO3 |
某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴、滤纸.从缺少仪器角度看不能进行的实验项目是( )
| A、蒸发 | B、萃取 | C、过滤 | D、蒸馏 |
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X(要求甲和X能互换)不可能是[提示:Al3++3AlO2-+6H2O=4Al(OH)3↓]( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X(要求甲和X能互换)不可能是[提示:Al3++3AlO2-+6H2O=4Al(OH)3↓]( )| A、C和O2 |
| B、SO2和NaOH溶液 |
| C、Cl2和Fe |
| D、AlCl3溶液和NaOH溶液 |
在3S+6KOH=2K2S+K2SO3+3H2O这个反应中,被氧化与被还原的S原子个数比( )
| A、1:2 | B、2:1 |
| C、1:1 | D、3:1 |