题目内容
13.下列指定反应的离子方程式正确的是( )| A. | 铝溶于NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| B. | 铜丝插入Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向FeBr2溶液中通入过量Cl2:2Br-+Cl2═Br2+2Cl- | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- |
分析 A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.氯气足量,亚铁离子和溴离子都被氧化;
D.二氧化碳过量,反应生成碳酸氢根离子.
解答 解:A.铝溶于NaOH溶液中的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故A正确;
B.铜丝插入Fe2(SO4)3溶液中,反应生成硫酸亚铁和硫酸铜,正确的离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,故B错误;
C.氯气具有氧化性,能将亚铁离子和溴离子氧化,先氧化亚铁离子,通入足量的Cl2,此时Fe2+、溴离子都全部被氧化,正确的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C错误;
D.Na2SiO3溶液中通入过量CO2,反应生成硅酸和碳酸氢钠,正确的离子方程式为:SiO32-+2CO2+2H2O═H2SiO3+2HCO3-,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
4.己知室温时Ksp[Mg(OH)2]=1.8×l0-11,則此温度下Mg(OH)2在pH=12的NaOH溶液中的最大溶解浓度为( )
| A. | 1.8×l0-7mol/L | B. | 1.0×l0-5mol/L | C. | 1.0×l0-7mol/L | D. | 1.8×l0-9mol/L |
1.进行化学实验、观察实验现象,通过分析推理得出正确的结论是化学学习方法之一.下列说法正确的是( )
| A. | 证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉一KI试纸检验,观察试纸颜色的变化 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出气体和SO2的体积比为2:3 | |
| C. | 验证淀粉水解产物是否具有还原性,取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀 | |
| D. | 在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,该过程中总反应为2A1+3Ag2S═6Ag+Al2S3 |
8.下列仪器名称为“蒸馏烧瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
18.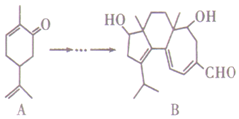 如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
 如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )| A. | A的化学式为C10H14O | |
| B. | 与A互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 | |
| C. | A和B均能使酸性KMnO4溶液褪色 | |
| D. | B可以发生加成反应、消去反应和氧化反应 |
2.下列有关实验原理、装置、操作或结论的描述中,正确的是( )
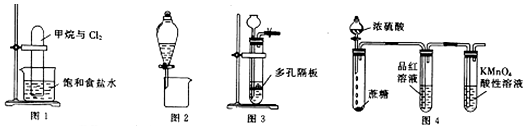

| A. | 图1可实现甲烷与氯气在光照条件下的置换反应 | |
| B. | 图2可分离CH3CH3OH和CH3COOC2H5的混合液 | |
| C. | 图3可用于锌粒与稀硝酸反应制备氢气 | |
| D. | 图4可说明浓H2SO4具有脱水性和强氧化性,SO2具有漂白性和还原性 |
 .
.
 .
.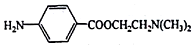 )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件己省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件己省略):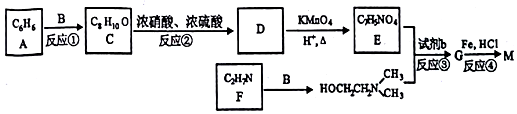
 的结构不稳定.
的结构不稳定.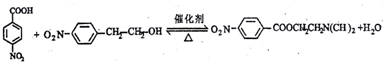 .
.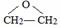 、FH3C-NH-CH3.
、FH3C-NH-CH3.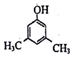 、
、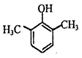 、
、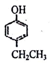 .
.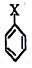 ,若-X为烃基或羟基,再次取代时,新取代基在-X的邻位或对位;若-X为羧基或硝基,再次取代时,新取代基在-X的间位.参照上述合成路线,设计由甲苯合成
,若-X为烃基或羟基,再次取代时,新取代基在-X的邻位或对位;若-X为羧基或硝基,再次取代时,新取代基在-X的间位.参照上述合成路线,设计由甲苯合成 的合成路线(用合成路线流程图表示,并注明反应条件,合成过程中无机试剂可任选).
的合成路线(用合成路线流程图表示,并注明反应条件,合成过程中无机试剂可任选). .
.