题目内容
8.有机物的结构可用“键线式”简化表示.(1)物质X:CH3CH=CHCH3可表示为
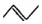
X可以与溴水反应,该反应的化学方程式是CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3;
X可以发生加聚反应,其产物分子的结构简式是
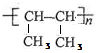 .
.(2)一种有机物Y的键线式如图所示

①Y的分子式为C8H8;
②有机物Z是X的同分异构体,且属于芳香族化合物,则Z的结构简式是
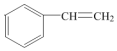 .
.
分析 (1)烯烃碳碳双键与溴单质发生加成反应;含有碳碳双键,可发生加聚反应;
(2)①将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,据此写出有机物的分子式;
②物质X的分子式为C8H8,含有苯环,为苯乙烯.
解答 解:(1)①CH3CH=CHCH3含有碳碳双键,与溴单质发生加成反应:CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3,
故答案为:CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3;
②CH3CH=CHCH3含有碳碳双键,可发生加聚反应,nCH3CH=CHCH3$\stackrel{一定条件}{→}$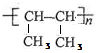 ,
,
故答案为: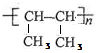 ;
;
(2)①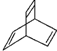 分子中含有8个碳原子和8个氢原子,其分子式为C8H8,故答案为:C8H8;
分子中含有8个碳原子和8个氢原子,其分子式为C8H8,故答案为:C8H8;
②物质X的分子式为C8H8,有机物Z是X的同分异构体,且属于芳香族化合物,为苯乙烯 ,故答案为:
,故答案为: .
.
点评 本题考查了有机物结构、键线式的表示方法,题目难度中等,明确键线式的概念及表示方法为解答关键,注意熟练掌握常见有机物结构与性质,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.短周期主族元素W、X、Y、Z的原子序数依次增大,四种原子的最外层电子数之和为19.X原子的电子总数与最外层电子数之比为l:3,Y原子的最外层电子数与其内层电子总数之比为1:10.下列说法正确的是( )
| A. | 简单离子的半径:Y>X | |
| B. | 最简单气态氢化物的稳定性:W>X | |
| C. | 化合物WX、YZ中化学键类型相同 | |
| D. | W、Z的最高价氧化物对应的水化物均为强酸 |
19.下列说法正确的是( )
| A. | SO2与SO3互为同分异构体 | |
| B. | 氢气是理想的绿色能源 | |
| C. | 单质中不存在化学键 | |
| D. | 电解饱和氯化钠溶液可能得到金属钠 |
16.对于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,下列反应速率关系中,正确的是( )
| A. | 3v(N2)=v(H2) | B. | v(N2)=3v(H2) | C. | 1.5v(H2)=v(NH3) | D. | v(N2)=2v(NH3) |
3.关于配合物[Cu(H2O)4]SO4,下列说法错误的是( )
| A. | 此配合物,中心离子的配位数为4 | |
| B. | H2O为配体,配位原子是氧原子 | |
| C. | 此配合物中,Cu2+提供孤对电子 | |
| D. | 向此配合物溶液中加入BaCl2溶液,出现白色沉淀 |
13.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 非金属性:Cl>Br |
20.下列关于化学反应限度的说法正确的是( )
| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 可以通过延长化学反应时间改变化学反应限度 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而发生改变 |
17.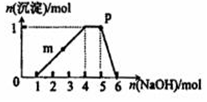 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )| A. | m点处反应:H++OH-═H2O | |
| B. | p点:c(NH4+)>c(OH-)>c(H+) | |
| C. | 若取原溶液做焰色反应实验,焰色应为黄色 | |
| D. | 原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+) |
13.下列指定反应的离子方程式正确的是( )
| A. | 铝溶于NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| B. | 铜丝插入Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向FeBr2溶液中通入过量Cl2:2Br-+Cl2═Br2+2Cl- | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- |