题目内容
8.下列仪器名称为“蒸馏烧瓶”的是( )| A. |  | B. |  | C. |  | D. |  |
分析 “蒸馏烧瓶”为分离互溶的液体的仪器,特征为瓶颈处有一略向下伸出的细玻璃管,可用于引流蒸汽,蒸汽通过冷凝管,变成液体,据此分析.
解答 解:A.图示为圆底烧瓶,无支管,故A错误;
B.图示为冷凝管,用于冷凝气体,故B错误;
C.图示为容量瓶,用于配制一定物质的量浓度的溶液,故C错误;
D.图示仪器特征为瓶颈处有一略向下伸出的细玻璃管,为蒸馏烧瓶,故D正确;
故选D.
点评 本题考查仪器的识别,掌握蒸馏烧瓶特征是解答该题的关键,了解仪器的名称、用途、使用方法和注意事项,是解答该类题的前提,题目较简单.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
3.关于配合物[Cu(H2O)4]SO4,下列说法错误的是( )
| A. | 此配合物,中心离子的配位数为4 | |
| B. | H2O为配体,配位原子是氧原子 | |
| C. | 此配合物中,Cu2+提供孤对电子 | |
| D. | 向此配合物溶液中加入BaCl2溶液,出现白色沉淀 |
4.下列叙述错误的是( )
| A. | 常温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性C(Na+)>c(SO42-)>c(NH4+)>c(OH-)=C(H+) | |
| B. | 向饱和NaClO溶液中滴加少量饱和FeSO4溶液,反应的离子方程式为2Fe2++ClO-+5H2O═2Fe(OH)3↓+Cl-+4H+ | |
| C. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH2COO-)-c(CH2COOH) | |
| D. | 常温下cmol/L、电离常数为Ka的酸HA溶液中,由水电离的浓度为c(H+)水=$\frac{1{0}^{-14}}{\sqrt{Ka•c}}$mol•L-1 |
16.下列说法正确的是( )
| A. | 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a | |
| B. | 常温下0.1 mol•L-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A) | |
| C. | 室温时 M(OH)2(s)?M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b mol•L-1 时,溶液的pH为14+$\frac{1}{2}$1g$\frac{a}{b}$ | |
| D. | 0.1 mol•L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
3.下列有关化学用语表示正确的是( )
| A. | 中子数为8的氮原子:${\;}_{8}^{15}$N | B. | 乙醇的实验式:C2H6O | ||
| C. | 氯化镁的电子式: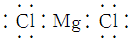 | D. | 硫原子的结构示意图: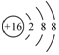 |
13.下列指定反应的离子方程式正确的是( )
| A. | 铝溶于NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| B. | 铜丝插入Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向FeBr2溶液中通入过量Cl2:2Br-+Cl2═Br2+2Cl- | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- |
20.第三周期,基态原子的第一电离能处于Al、P之间的元素有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
17.部分短周期元素的性质或原子结构如表所示.下列叙述不正确的是( )
| 元素代号1 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液呈碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+7价 |
| A. | 化合物WY2不溶于水 | |
| B. | 原子半径:W>X>Y | |
| C. | 最高价氧化物对应水化物的酸性:W<Z | |
| D. | 由X、Y和氢三种元素形成的所有化合物中只含共价键 |
10.用下列实验装置进行相应实验,下列说法正确的是( )
| A. |  用如图所示装置分离沸点相差较大的互溶液体混合物 | |
| B. |  用如图所示装置除去NaCO3固体中混有的NaHCO3 | |
| C. |  用如图所示装置除去Cl2中含有的HCl | |
| D. |  用如图所示装置进行电解法制离Cl2和H2 |