题目内容
16.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.(1)化合物 LiNH2是一种储氢容量高、安全性好的固体储氢材料,其储氢原理表示为:
Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
①LiNH2的电子式
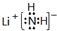 .
.②写出Li3N固体与氢气反应转化为LiNH2的热化学方程式Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1.
(2)乙苯催化生产苯乙烯可得到H2副产物,反应如下:
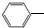 CH2CH3(g)?催化剂
CH2CH3(g)?催化剂 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)在实际生产时,反应在常压(101KPa)下进行,且向乙苯蒸气中掺入水蒸气.图1是不同温度和不同投料比[M=n(H2O)n(乙苯)]情况下,乙苯平衡转化率的变化曲线.
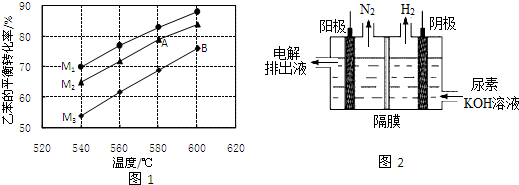
①用平衡分压代替平衡浓度,列出540℃下该反应的平衡常数计算式K=$\frac{(\frac{0.7}{1.7}×101)^{2}}{\frac{0.3}{1.7}×101}$.(分压=总压×物质的量分数)
②图中A、B两点对应的平衡常数大小:KA<KB.(填“>”、“<”或“=”)
③投料比(M1、M2、M3)的大小顺序为M1>M2>M3.判断理由为恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动.
④随着反应的进行,催化剂上出现少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是C+H2O 高温?CO+H2(用化学方程式表示).
(3)电解碱性尿素[CO(NH2)2]溶液可以制得氢气,装置如图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
分析 (1)①LiNH2为离子化合物,是锂离子Li+和NH2-离子构成;
②Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
依据盖斯定律计算得到Li3N固体与氢气反转化为LiNH2的热化学方程式;
(2)①用平衡分压代替平衡浓度,540℃下乙苯转化率为70%,该反应的平衡常数计算式等于生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积,分压=总压×物质的量分数;
②随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高;
③乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值;
④催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性是因为碳和水蒸气在高温下反应生成一氧化碳气体和氢气,除去表面的积碳;
(3)根据图2可知:该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极是阳极,阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水;生成氢气的电极是阴极.
解答 解:(1)①LiNH2为离子化合物,是锂离子Li+和NH2-离子构成,电子式为: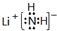 ,
,
故答案为: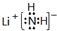 ;
;
②Ⅰ.Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Ⅱ.Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ得到Li3N固体与氢气反应转化为LiNH2的热化学方程式:Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1 ,
故答案为:Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1;
(2)① CH2CH3(g)$\frac{\underline{\;催化剂\;}}{\;}$
CH2CH3(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH=CH2(g)+H2(g),
CH=CH2(g)+H2(g),
用平衡分压代替平衡浓度,540℃下乙苯转化率为70%,设起始乙苯物质的量为1mol,
 CH2CH3(g)$\frac{\underline{\;催化剂\;}}{\;}$
CH2CH3(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH=CH2(g)+H2(g),
CH=CH2(g)+H2(g),
起始量(mol) 1mol 0 0
变化量(mol) 1mol×70%=0.7mol 0.7mol 0.7mol
平衡量(mol) 0.3mol 0.7mol 0.7mol
540℃下该反应的平衡常数计算式K=$\frac{\frac{0.7mol}{1.7mol}×101pa×\frac{0.7mol}{1.7mol}×101pa}{\frac{0.3mol}{1.7mol}×101pa}$=$\frac{(\frac{0.7}{1.7}×101)^{2}}{\frac{0.3}{1.7}×101}$,
故答案为:$\frac{(\frac{0.7}{1.7}×101)^{2}}{\frac{0.3}{1.7}×101}$;
②图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,
故答案为:<;
③乙苯量越多,投料比越小,乙苯转化率越小,恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动,据此分析判断M的值,M1>M2>M3,
故答案为:M1>M2>M3;恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动;
④催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性是因为碳和水蒸气在高温下反应生成一氧化碳气体和氢气,除去表面的积碳,反应的化学方程式为:C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2.
(3)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成;阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
点评 本题考查了化学平衡的计算、电解池原理、平衡常数计算、图象分析应用,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡的计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案(1)请写出氨气与水反应的化学方程式,并据此推断氨水中含有哪些分子(用化学式表示).
(2)氨水中哪些物质能发生电离?请写出电离方程式,并据此分析氨水中存在的离子.
| A. | 探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生气体的快慢,来反映试剂反应速率的大小.从而探究浓度温度等外界条件对该反应的化学反应速率的影响 | |
| B. | 容量瓶、滴定管上都标有使用温度和“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 | |
| C. | 油脂皂化反应后的反应液中加入饱和食盐水并搅拌后出现分层,则生成的高级脂肪酸钠在下层 | |
| D. | 只用 NaHCO3 溶液就可鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 |
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是d e.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
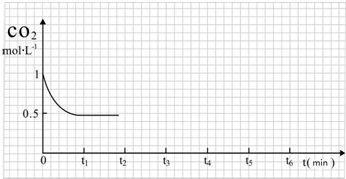
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.
(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
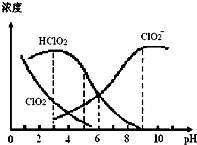 亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 不同pH的NaClO2溶液中存在下列关系:c ( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) | |
| D. | 该温度下HClO2的电离平衡常数的数值:Ka≈1.0×10-6 |
| A. | SO2能使溴水褪色,体现其漂白性 | |
| B. | NOx、CO2、PM 2.5颗粒都会导致酸雨 | |
| C. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| D. | 等质量的NaHCO3按a、b两种途径完全转化,途径a比途径b消耗更多的盐酸 途径a:NaHCO3 $\stackrel{△}{→}$Na2CO3 $\stackrel{盐酸}{→}$CO2;途径b:NaHCO3$\stackrel{盐酸}{→}$CO2 |
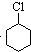 (一氯环己烷)$→_{②}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{②}^{NaOH,乙醇,△}$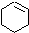 $→_{③}^{Br_{2}的CCl溶液}$
$→_{③}^{Br_{2}的CCl溶液}$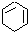 $\stackrel{④}{→}$
$\stackrel{④}{→}$ ,名称是环己烷
,名称是环己烷 .
.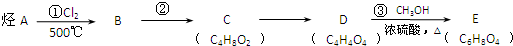
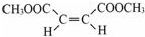 ;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
 .
.