题目内容
1.分子式为C10H20O2的酯水解生成A和B,已知A氧化可生成相对分子质量与B相同的酸C,则该酯的同分异构体数目为( )| A. | 8 | B. | 12 | C. | 16 | D. | 32 |
分析 分子式为C10H20O2的酯水解生成A和B,根据分子组成可知应为饱和一元酸和饱和一元醇形成的酯,已知A氧化可生成相对分子质量与B相同的酸C,说明A和B的碳原子数相同,与羟基所连碳上有2个氢原子,即A为:C4H9CH2OH,B为C4H9COOH,分析烃基即可解答该题.
解答 解:分子式为C10H20O2的酯水解生成A和B,根据分子组成可知应为饱和一元酸和饱和一元醇形成的酯,已知A氧化可生成相对分子质量与B相同的酸C,说明A和B的碳原子数相同,与羟基所连碳上有2个氢原子,即A为:C4H9CH2OH,B为C4H9COOH,烃基C4H9-有4种结构:C-C-C-C-, ,
, ,所以酯可能的结构有4×4=16,由于B酸不是C酸,所以要扣除4种,符合题意的酯有12种,
,所以酯可能的结构有4×4=16,由于B酸不是C酸,所以要扣除4种,符合题意的酯有12种,
故选:B.
点评 本题考查有机物的推断,本题的关键是根据A氧化可生成相对分子质量与B相同的酸C得出:A和B的碳原子数相同,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.原子序数依次增大的短周期元素A、B、C、D,其中A 元素的一种核素形成的单质是核聚变的理想材料,B 元素原子最外层电子数是电子层数的3 倍;C 元素原子为它所在周期中原子半径最大的主族元素;D 元素是地壳中含量最丰富的金属元素.下列叙述正确的是( )
| A. | B、C、D 形成的简单离子半径依次增大 | |
| B. | B、C 形成的化合物只含有离子键 | |
| C. | A、C、D 形成的化合物CDA4,属于离子化合物,有较强的还原性 | |
| D. | A、B、C 形成的化合物与B、C、D 形成的化合物可以发生化学反应 |
6.制乙烯时,还产生少量SO2、CO2及水蒸气,某研究小组用下列装置检验这四种气体,仪器连接顺序正确的是( )
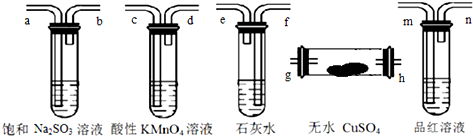

| A. | h-g-m-n-a-b-f-e-c-d | B. | g-h-m-n-a-b-e-f-c-d | ||
| C. | h-g-c-d-m-n-f-e-a-b | D. | h-g-m-n-c-d-e-f-a-b |
13.下列说法不正确的是( )
| A. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| B. | 正戊烷的沸点高于丙烷 | |
| C. | 1 mol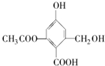 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、3mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、3mol、1 mol | |
| D. | 分子式为C4H8O2的有机物能与NaOH溶液反应的有6种 |
10.在298K、1.01×105 Pa下,将22gCO2通入750mL 1mol•L-1 NaOH 溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1molCO2通入1L2mol•L-1 NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
11.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 | |
| B. | NaCl$\stackrel{通电}{→}$Na$\stackrel{TiCl_{4}溶液}{→}$ Ti | |
| C. | MgCl2•6H2O $\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
 NA表示阿伏加德罗常数的值,下列说法中正确的有几项( )
NA表示阿伏加德罗常数的值,下列说法中正确的有几项( )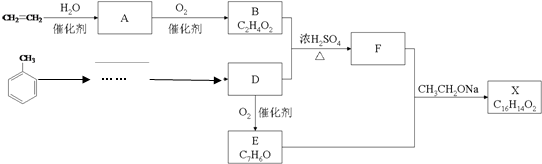
 .
. CH2OCH2CH2CHO
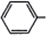
CH2OCH2CH2CHO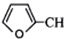 =CHCH2CH2CHCHO
=CHCH2CH2CHCHO COOCH2CH2CH3
COOCH2CH2CH3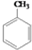 到D的合成路线(无机试剂任选,用合成路线流程图表示).
到D的合成路线(无机试剂任选,用合成路线流程图表示).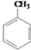 →
→ .
. CH2CH3(g)?催化剂
CH2CH3(g)?催化剂