题目内容
1.用NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压下,14 g 氮气含有的原子数目为 NA | |
| B. | 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA | |
| C. | 标况时,22.4L水所含水分子的数目为1NA | |
| D. | 56g铁与过量硫酸反应,需失去3NA个电子 |
分析 A、氮气由氮原子构成;
B、溶液体积不明确;
C、标况下水为液体;
D、求出铁的物质的量,然后根据铁与硫酸反应后变为+2价来分析.
解答 解:A、氮气由氮原子构成,故14g氮气中含有的氮原子的物质的量为1mol,个数为NA个,故A正确;
B、溶液体积不明确,故溶液中含有的氯原子个数无法计算,故B错误;
C、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、56g铁的物质的量为1mol,而铁与硫酸反应后变为+2价,故1mol铁反应后转移2mol电子即2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
8.下列各醇中,能发生消去反应生成(CH3)2C═CH2的是( )
| A. | CH3-OH | B. |  | C. | C2H5OH | D. |  |
6.铁及其化合物在日常生活中应用广泛.已知Fe(NO3)3•9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂.工业上用细铁屑(含有少量杂质Cu)与稀硝酸反应制备,主要流程如下:
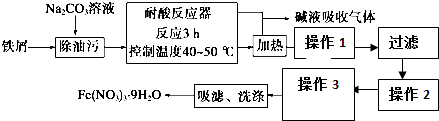
(1)Na2CO3溶液可以除油污,原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-
(2)操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L,能否视为Fe3+已经沉淀完全?是(是、否).
(3)操作2是在滤渣中加入足量的硝酸,硝酸足量的目的将Fe(OH)3完全溶解、抑制Fe3+水解
(4)操作3包含两步,分别为:蒸发浓缩、冷却结晶
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,目的:洗去表面杂质,减少因溶解而造成的损失.

| 物质 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 2.6×10-39 |
(2)操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L,能否视为Fe3+已经沉淀完全?是(是、否).
(3)操作2是在滤渣中加入足量的硝酸,硝酸足量的目的将Fe(OH)3完全溶解、抑制Fe3+水解
(4)操作3包含两步,分别为:蒸发浓缩、冷却结晶
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,目的:洗去表面杂质,减少因溶解而造成的损失.
13.已知分解1g碳酸镁固体吸收1.366kJ,则它的热化学方程式是( )
| A. | MgCO3(s)═MgO(s)+CO2(g)△H=+1.366 kJ/mol | |
| B. | MgCO3(s)═MgO(s)+CO2(g)△H=-1.366 kJ/mol | |
| C. | MgCO3(s)═MgO(s)+CO2(g)△H=-114.7 kJ/mol | |
| D. | MgCO3(s)═MgO(s)+CO2(g)△H=+114.7 kJ/mol |
10.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的物质的量相等 | |
| D. | Na2O2的漂白原理与活性炭的漂白原理相同 |
11.下列有关的离子方程式书写正确的是( )
| A. | 氢氧化钡溶液和稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 碳酸钙和醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4 NH3•H2O═AlO2-+4NH4++2 H2O | |
| D. | 用少量Ca(OH)2与NaHCO3反应:Ca2++2OH-+2HCO3-═CaCO3↓+H2O+CO32- |
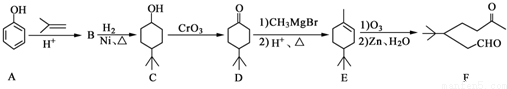
 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基.
.同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基. (任写一种).
(任写一种).