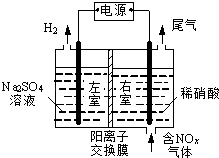
题目内容
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: SO2(g)+NH3H2O(aq)=NH4HSO3(aq)△H1=a kJmol﹣1
NH3H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=c kJmol﹣1
(1)反应2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=kJmol﹣1 .
(2)空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是 . 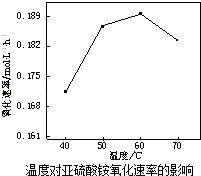
(3)以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用.反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= . [已知Ksp(CaCO3)=2.9×10﹣9 , Ksp(CaSO4)=9.1×10﹣6]
(4)(NH4)2SO4在工农业生产中有多种用途. ①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气.该反应的化学方程式为 .
②研究硫酸铵的分解机理有利于对磷石膏的开发.在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示.写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目: .
③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路: . 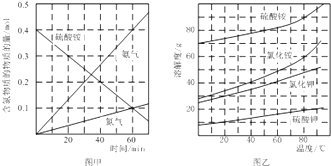
【答案】
(1)2a+2b+c
(2)温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低)
(3)3138
(4)2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O;
4CuSO4+4NH3+2H2O;![]() ;配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
;配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
【解析】解:(1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3H2O(aq)═NH4HSO3(aq)△H1=a kJmol﹣1;②NH3H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJmol﹣1;盖斯定律计算目标反应的反应热为:①×2+②×2+③,2SO2(g)+4NH3H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)△H=(2a+2b+c)KJ/mol,
故答案为:2a+2b+c;(2)根据图1分析,60℃氧化速率最快,则在空气氧化(NH4)2SO3的适宜温度为60℃,温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低),
故答案为:温度过高(NH4)2SO3会分解(或水解),浓度减小(或温度升高氧气在溶液中溶解度降低);(3)反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= ![]() =
= ![]() ×
× ![]() =
= ![]() =
= ![]() =3138,
=3138,
故答案为:3138;(4)①将黄铜精矿主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合电子守恒和原子守恒配平书写,反应的化学方程式为:2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O,
4CuSO4+4NH3+2H2O,
故答案为:2Cu2S+2(NH4)2SO4+5O2 ![]() 4CuSO4+4NH3+2H2O;
4CuSO4+4NH3+2H2O;
②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写得到化学方程式为:3(NH4)2SO4 ![]() N2↑+4NH3↑+3SO2↑+6H2O↑,氮元素化合价﹣3价变化为0价,硫元素化合价+6价变化为+4价,电子转移总数6e﹣ ,
N2↑+4NH3↑+3SO2↑+6H2O↑,氮元素化合价﹣3价变化为0价,硫元素化合价+6价变化为+4价,电子转移总数6e﹣ ,
单线桥标出电子转移的方向及数目为: ![]() ,
,
故答案为: ![]() ;
;
③根据复分解反应发生的条件和图像中物质溶解度分析,常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,故反应可以进行,工业上制备K2SO4晶体的设计思路是:配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤得到,
故答案为:配制较高温度(80℃﹣100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤;
(1)①根据盖斯定律,给已知方程式编号①SO2(g)+NH3H2O(aq)═NH4HSO3(aq)△H1=a kJmol﹣1;②NH3H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJmol﹣1;③2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJmol﹣1;目标反应的反应热为:①×2+②×2+③,由此分析解答;(2)根据图1分析,60℃氧化速率最快,温度过高(NH4)2SO3会分解; (3)反应的离子方程式为CaSO4(s)+CO32﹣(aq)SO42﹣(aq)+CaCO3(s),该反应的平衡常数K= ![]() =
= ![]() ×
× ![]() =
= ![]() ;(4)①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合原子守恒配平书写化学方程式;②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写;③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,从生成物的溶解度大小考虑反应能否发生;
;(4)①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气和水,结合原子守恒配平书写化学方程式;②在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示,硫酸铵分解生成氮气、氨气、二氧化硫和水,结合电子守恒和原子守恒配平书写;③(NH4)2SO4是工业制备K2SO4的重要原料.根据图乙中相关物质的溶解度曲线,从生成物的溶解度大小考虑反应能否发生;

【题目】以苯甲醛为原料制取苯甲醇和苯甲酸的合成反应如下: 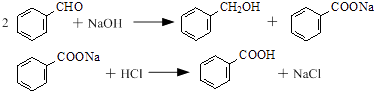
相关物质的部分物理性质见下表:
名称 | 相对密度 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | ﹣26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | ﹣15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | ﹣116.3 | 34.6 | 不溶 | ﹣﹣ |
实验流程如下:
(1)萃取时苯甲醇在分液漏斗的(填“上”或“下”)层,分液漏斗振摇过程中需慢慢开启旋塞几次,其原因是 .
(2)用NaHSO3溶液、10%Na2CO3溶液、H2O洗涤乙醚层. ①用10%Na2CO3溶液洗涤目的是 .
②操作Ⅰ名称是 .
(3)抽滤操作结束时先后进行的操作是 .
(4)提纯粗产品乙的实验方法为 .