题目内容
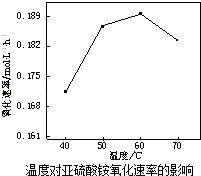
【题目】25℃时,NH3H2O的电离平衡常数Kb=1.75×10﹣5 , 该温度下,用0.01molL﹣1盐酸滴定10mLamolL﹣1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( ) 
A.A点溶液中加少量水, ![]() 减小
减小
B.原氨水的物质的量浓度约为1.006×10﹣2mol?L﹣1
C.B,D两点溶液中水电离出来的c(OH﹣):B<0
D.C点溶液中的H2O不发生电离
【答案】B
【解析】解:A、A点溶液中加少量水,促进氨水的电离,在 ![]() 的分子和分母同乘以氢氧根离子的浓度,得
的分子和分母同乘以氢氧根离子的浓度,得 ![]() ,一水合氨的浓度减小,所以
,一水合氨的浓度减小,所以 ![]() 变大,故A错误;B、C点等体积混合溶液呈中性,所以c(Cl﹣)=c(HCl)=c(NH4+)<c(NH3H2O),所以氨水的物质的量浓度约为1.006×10﹣2molL﹣1 , 故B正确;
变大,故A错误;B、C点等体积混合溶液呈中性,所以c(Cl﹣)=c(HCl)=c(NH4+)<c(NH3H2O),所以氨水的物质的量浓度约为1.006×10﹣2molL﹣1 , 故B正确;
C、B点是氨水和氯化氨的混合溶液,对水的电离起抑制作用,水电离出的氢氧根离子等于溶液中的氢离子的浓度10﹣9mol/L,而D点是盐酸和氯化铵的混合物,对水的电离起抑制作用,水电离出的氢氧根离子等于溶液中的氢氧根离子的浓度10﹣9mol/L,所以B、D两点溶液中水电离出来的c(OH﹣):B=D,故C错误;
D、电解质水溶液中都存在水的电离,而不是水不发生电离,只不过电离程度大小不同,故D错误;
故选B.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).

【题目】现有三组液体混合物:①汽油和氯化钠溶液 ②乙醇与水 ③单质溴和水,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取D. 蒸馏、萃取、分液
【题目】Na、Cu、Fe、Cl、O、N是常见的6种元素.
(1)Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为 .
(2)用“>”或“<”填空:
第一电离能 | 原子半径 | 稳定性 |
NO | CNa | NH3H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目 .