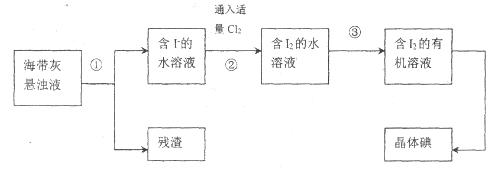
题目内容
【题目】电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极). 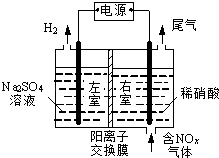
(1)若用NO2气体进行模拟电解法吸收实验. ①写出电解时NO2发生反应的电极反应式: .
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为mol.
(2)某小组在右室装有10L0.2molL﹣1硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验. ①实验前,配制10L0.2molL﹣1硝酸溶液需量取mL的密度为1.4gmL﹣1、质量分数为63%的浓硝酸.
(3)②电解过程中,有部分NO转化为HNO2 , 实验结束时,测得右室溶液中含3molHNO3、0.1molHNO2 , 同时左室收集到标准状况下28LH2 . 计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程).
【答案】
(1)NO2﹣e﹣+H2O=NO3﹣+2H+;0.1
(2)142.9
(3)解:n(H2)= ![]() =1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成, 根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 molL-1×10 L+0.1 mol=1.1 mol, 生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol, 设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒得:x+y=1.1-0.1,3x+y=2.4,解得x=0.7,y=0.3, n(NO):n(NO2)=(0.7+0.1)mol:0.3mol=8:3,相同条件下气体的体积之比等于物质的量之比,所以NO和NO2的体积之比为8:3
=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成, 根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 molL-1×10 L+0.1 mol=1.1 mol, 生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol, 设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒得:x+y=1.1-0.1,3x+y=2.4,解得x=0.7,y=0.3, n(NO):n(NO2)=(0.7+0.1)mol:0.3mol=8:3,相同条件下气体的体积之比等于物质的量之比,所以NO和NO2的体积之比为8:3
【解析】解:(1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸,电极反应式为NO2-e-+H2O=NO3-+2H+ , 所以答案是:NO2-e-+H2O=NO3-+2H+;②n(NO2)= ![]() =0.1mol,阳极反应式为NO2﹣e﹣+H2O=NO3﹣+2H+ , 有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室;所以答案是:0.1;(2)①浓硝酸的物质的量浓度=
=0.1mol,阳极反应式为NO2﹣e﹣+H2O=NO3﹣+2H+ , 有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室;所以答案是:0.1;(2)①浓硝酸的物质的量浓度= ![]() =
= ![]() mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算;(3)②n(H2)=
mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算;(3)②n(H2)= ![]() =1.25mol,
=1.25mol,
根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol, 电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2 , 说明电解过程中有1mol HNO3、0.1molHNO2生成, 根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 molL-1×10 L+0.1 mol=1.1 mol, 生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol, 设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒得:x+y=1.1-0.1,3x+y=2.4,解得x=0.7,y=0.3, n(NO):n(NO2)=(0.7+0.1)mol:0.3mol=8:3,相同条件下气体的体积之比等于物质的量之比,所以NO和二氧化氮的体积之比为8:3