题目内容
16.下列有关化学用语表示正确的是( )| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: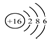 | ||
| C. | 过氧化钠的电子式: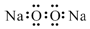 | D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
分析 A、氯乙烯是用一个氯原子取代了乙烯中的一个H原子形成的;
B、硫原子的核内有16个质子,核外有16个电子;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、将质量数写在原子符号的左上角.
解答 解:A、氯乙烯是用一个氯原子取代了乙烯中的一个H原子形成的,故结构简式为CH2=CHCl,故A错误;
B、硫原子的核内有16个质子,核外有16个电子,故结构示意图为 ,故B正确;
,故B正确;
C、过氧化钠由2个钠离子和1个过氧根构成,故过氧化钠的电子式为 ,故C错误;
,故C错误;
D、将质量数写在原子符号的左上角,质量数=质子数+中子数=10+8=18,故原子符号为188O,故D错误.
故选B.
点评 本题考查了结构简式、原子结构示意图、电子式和原子符号的书写,难度不大,应注意的是离子化合物和共价化合物电子式书写的区别.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.某原子含有6个电子、7个中子,它的化学符号为( )
| A. | 13C | B. | 13Al | C. | 13C | D. | 13Al |
7.${\;}_{53}^{131}$I是一种人工放射性核素.下列关于${\;}_{53}^{131}$I的说法正确的是( )
| A. | 质量数为78 | B. | 质子数为53 | C. | 核外电子数为131 | D. | 中子数为53 |
4.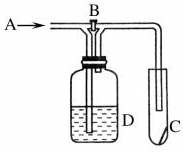 如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
 如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓NaI溶液 | B. | 浓NaOH溶液 | C. | 饱和NaCl溶液 | D. | 浓硫酸 |
11.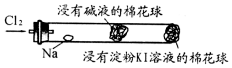 某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
烧,并产生大量白烟.以下叙述错误的是( )
 某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃
某兴趣小组设计“氯气与金属钠反应”的装置.实验操作:先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
| A. | 钠着火燃烧产生苍白色火焰和白烟 | |
| B. | 白烟是氯化钠微晶分散在空气中形成 | |
| C. | 玻管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境 | |
| D. | 根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收 |
4.电镀污泥中包含大量难以降解的贵重金属离子,如Zn2+、Pb2+、Fe2+、Fe3+、Cr3+、Ca2+等.在回收过程中,如果对其处理不当或者未经处理就进行填埋,将会给环境和社会带来极大的危害.以下是回收流程:
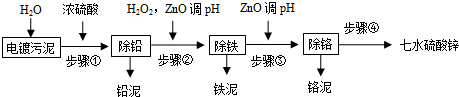
已知:
①各离子开始沉淀和完全沉淀的pH值如下表:
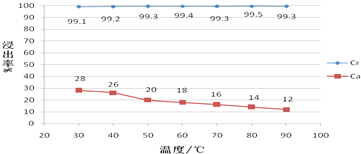
②温度对各离子的浸出率影响如图:
(1)请写出步骤①除铅的离子方程式:Pb2++SO42-=PbSO4↓.
(2)步骤②加入双氧水的离子反应方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,调pH的范围是3.2~3.9.
(3)步骤③加入ZnO调pH的原理是(用离子方程式表示)Cr3++3H2O?Cr(OH)3+3H+、ZnO+2H+=Zn2++H2O;铬泥的主要成分是Cr(OH)3.
(4)步骤④的操作方法是蒸发浓缩、冷却结晶、洗涤、干燥.
(5)由图可以看出在硫酸浸出Ca2+、Cr3+离子的过程中,Ca2+离子浸出率随温度的升高而减小,其原因是硫酸钙是微溶物且溶解度超过30℃以后,温度越高,溶解度越低,Cr3+离子浸出率受温度影响较小,可在常温下浸出,但在实验过程中为了降低溶液的黏度,改善浸出液的过滤性能,浸出液的温度维持在40-50℃,浸出流程中虽然没有加热设备,但仍能使浸出液保持在40-50℃的原因是浓硫酸稀释过程中会放出大量的热,浸出渣的主要成分是硫酸铅、硫酸钙.

已知:
①各离子开始沉淀和完全沉淀的pH值如下表:
| 离子 | Fe2+ | Fe3+ | Cr3+ | Zn2+ |
| 开始沉淀的pH值 | 5.9 | 2.3 | 3.9 | 5.7 |
| 完全沉淀的pH值 | 8.3 | 3.2 | 5.6 | 8.3 |

(1)请写出步骤①除铅的离子方程式:Pb2++SO42-=PbSO4↓.
(2)步骤②加入双氧水的离子反应方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,调pH的范围是3.2~3.9.
(3)步骤③加入ZnO调pH的原理是(用离子方程式表示)Cr3++3H2O?Cr(OH)3+3H+、ZnO+2H+=Zn2++H2O;铬泥的主要成分是Cr(OH)3.
(4)步骤④的操作方法是蒸发浓缩、冷却结晶、洗涤、干燥.
(5)由图可以看出在硫酸浸出Ca2+、Cr3+离子的过程中,Ca2+离子浸出率随温度的升高而减小,其原因是硫酸钙是微溶物且溶解度超过30℃以后,温度越高,溶解度越低,Cr3+离子浸出率受温度影响较小,可在常温下浸出,但在实验过程中为了降低溶液的黏度,改善浸出液的过滤性能,浸出液的温度维持在40-50℃,浸出流程中虽然没有加热设备,但仍能使浸出液保持在40-50℃的原因是浓硫酸稀释过程中会放出大量的热,浸出渣的主要成分是硫酸铅、硫酸钙.
11.实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等.
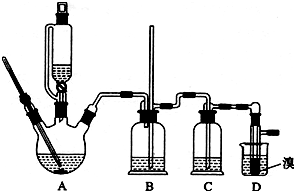
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)A装置上方使用滴液漏斗的优点是:便于漏斗内的液体是顺利滴下;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)B装置的作用是平衡压强,检测装置是否发生堵塞.
(3)在装置C中应加入c(填正确选项前的字母),其目的是吸收反应生成的SO2等酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(5)D装置具支试管内若用溴水代替液溴(假定产物相同),分析其优点产物1,2-二溴乙烷和水不互,溶分层,水在上层起着液封,防止产品挥发的作用.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯和溴单质反应放出热量,冷却可以避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的熔点为9℃,过度冷却会变成固体而使进气导管堵塞.
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/°C | 78.5 | 132 | 34.6 |
| 熔点/°C | -130 | 9 | -116 |
(1)A装置上方使用滴液漏斗的优点是:便于漏斗内的液体是顺利滴下;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)B装置的作用是平衡压强,检测装置是否发生堵塞.
(3)在装置C中应加入c(填正确选项前的字母),其目的是吸收反应生成的SO2等酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(5)D装置具支试管内若用溴水代替液溴(假定产物相同),分析其优点产物1,2-二溴乙烷和水不互,溶分层,水在上层起着液封,防止产品挥发的作用.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯和溴单质反应放出热量,冷却可以避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的熔点为9℃,过度冷却会变成固体而使进气导管堵塞.
8.某化学小组以苯甲酸( )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸(M=122g/mol)和20ml甲醇(密度约0.79g•mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O;浓硫酸的作用是:催化剂、吸水剂.
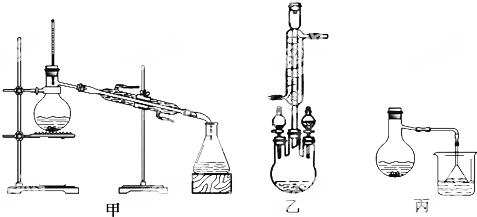
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用乙装置(填“甲”或“乙”或“丙”).
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ分液 操作Ⅱ蒸馏.

(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65% .
 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸(M=122g/mol)和20ml甲醇(密度约0.79g•mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O;浓硫酸的作用是:催化剂、吸水剂.
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用乙装置(填“甲”或“乙”或“丙”).

Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ分液 操作Ⅱ蒸馏.

(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65% .
