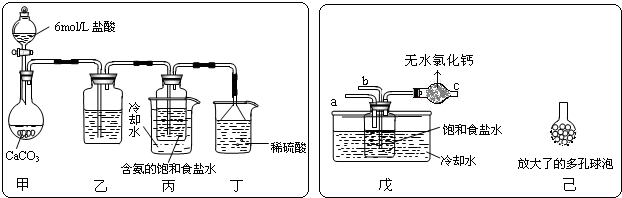
题目内容
8.某化学小组以苯甲酸( )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸(M=122g/mol)和20ml甲醇(密度约0.79g•mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O;浓硫酸的作用是:催化剂、吸水剂.
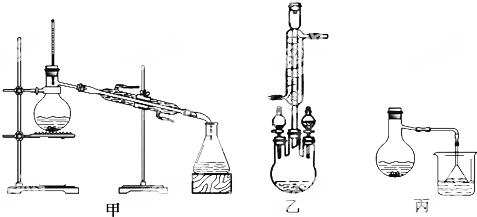
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用乙装置(填“甲”或“乙”或“丙”).
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ分液 操作Ⅱ蒸馏.

(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65% .
分析 Ⅰ.合成苯甲酸甲酯粗产品
(1)酯化反应机理为酸脱羟基醇脱氢,据此写出该反应的化学方程式,根据酯化反应中浓硫酸的作用进行解答;
(2)根据甲图、乙图装置的圆底烧瓶上没有冷凝管及甲醇易挥发进行分析;
Ⅱ.粗产品的精制
(3)分液用于分离两种不互溶的液体,蒸馏用于互溶但沸点相差较大的两种(或两种以上)液体分离;
(4)氢氧化钠是强碱,促进苯甲酸甲酯的水解,据此答题;
(5)产率=$\frac{实际产量}{理论产量}$×100%,根据反应物的物质的量判断过量,根据不足量计算出理论上生成苯甲酸甲酯的物质的量,再计算出其产率.
解答 解:Ⅰ.合成苯甲酸甲酯粗产品
(1)苯甲酸与甲醇在浓硫酸作用下的酯化反应为:苯甲酸脱去羟基,据此脱去羟基中的氢原子,二者反应生成苯甲酸甲酯,所以水中18O原子来自苯甲酸,反应的化学方程式为:C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O,浓硫酸在酯化反应中起到了催化剂作用,酯化反应为可逆反应,浓硫酸吸收反应生成的水,可以促进酯的生成,浓硫酸起到了吸水剂的作用,
故答案为:C6H5CO18OH+CH3OH $\frac{\underline{\;浓硫酸\;}}{△}$C6H5COOCH3+H218O;催化剂、吸水剂;
(2)由装置图可知,乙图的圆底烧瓶上有冷凝管,充分起到回流作用,甲图和丙图则没有,而本题中反应物甲醇沸点低,苯甲酸、苯甲酸甲酯的沸点远高于甲醇,若采用甲图、丙图,甲醇必定会大量挥发,不利于合成反应,所以应冷凝回流,减少甲醇的挥发,提高产率,
故答案为:乙;
Ⅱ.粗产品的精制
(3)苯甲酸甲酯不溶于水,操作Ⅰ分离出互不相溶的液体,通常采用分液操作完成;甲醇和苯甲酸甲酯相互溶解,二者沸点不同,可以通过蒸馏操作分离,
故答案为:分液;蒸馏;
(4)氢氧化钠是强碱,促进苯甲酸甲酯的水解,所以不能用NaOH溶液代替饱和碳酸钠溶液,
故答案为:否;氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失;
(5)12.2g苯甲酸的物质的量为:$\frac{12.2g}{122g/mol}$=0.1mol,20mL甲醇(密度约0.79g/mL)的物质的量为:$\frac{0.79g/ml×20ml}{32g/mol}$=0.49mol>0.1mol,
则理论上生成苯甲酸甲酯的物质的量为:0.1mol,质量为:136g/mol×0.1mol=13.6g,则苯甲酸甲酯的产率为:$\frac{8.84g}{13.6g}$×100%=65%,
故答案为:65%.
点评 本题通过苯甲酸甲酯的制备方法,考查了物质制备方案的设计与评价,题目难度中等,明确物质的制备原理为解答此类题的关键,该烃为乙酸乙酯的制备知识的迁移题目,充分考查了学生灵活应用所学知识的能力.

 字词句段篇系列答案
字词句段篇系列答案| A. | 标准状况下,两种气体的体积之比等于摩尔质量之比 | |
| B. | 常温常压下,两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下,两种气体的摩尔质量之比等于密度反比 | |
| D. | 同温同体积时,两种气体的物质的量之比等于压强之比 |
| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: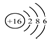 | ||
| C. | 过氧化钠的电子式: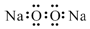 | D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
 甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.
甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.已知:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,某温度下的平衡常数为400.此温度下,在1L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.8 | 1.24 | ? |
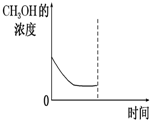
②若在平衡后的容器中再加入与起始时等量的CH3OH,请在下图中画出CH3OH的浓度的曲线示意图.
 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.982 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
将12.0g(0.2mol)乙酸、10.0g(0.1mol)环已醇和15mL 环已烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL98% 浓硫酸,恒压滴液漏斗换成分水器装置,加热回流90min,将反应液依次加水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168~174℃的馏分,得到无色透明有香味的液体,得产品6.9g
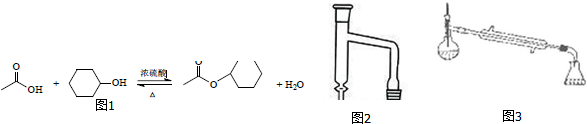
(1)上述反应装置图2中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环已醇的2 倍,其目的是提高环已醇的转化率.
(3)使用分水器(图3)的目的是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用10%的NaHCO3溶液目的是洗去硫酸和醋酸;第二次水洗 的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验产率为48.6%.
(6)若在进行蒸馏操作时,采用图3装置,会使实验的产率偏高 (填“偏高”“偏低”“无影响”),其原因是产品中会收集到未反应的环己醇.
| A. | 物质A、B的转化率之比为1:2 | |
| B. | 起始时刻和达平衡后容器中混合气体密度相等 | |
| C. | 当v正(A)=2v逆(C)时,可断定反应达到平衡状态 | |
| D. | 若起始时放入3 mol A和3 mol B,则达平衡时生成 3a mol C |
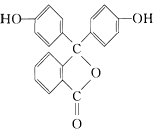
| A. | 1mol酚酞最多与2molNaOH发生中和反应 | |
| B. | 酚酞分子中所有碳原子不可能共平面 | |
| C. | 酚酞结构中有三个苯环,属于芳香烃 | |
| D. | 酚酞的分子式为C20H14O4 |