题目内容
下列说法正确的是( )
| A、向500mL 1 mol/LNa2CO3溶液中,滴加600mL 1 mol/LHCl 得到标况下CO2体积为2.24L |
| B、电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少64克 |
| C、将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol?L-1 |
| D、可用pH试纸测得氯水的酸性强弱 |
考点:电解原理,物质的量浓度,试纸的使用
专题:
分析:A.碳酸钠溶液中逐滴滴加盐酸,首先反应生成碳酸氢根离子,然后生成二氧化碳和水;
B.阳极为粗铜,含有比铜活泼的金属如铁、锌,先失电子;
C.将208 g BaCl2固体溶解在1 L水中,溶液的体积大于1L;
D.水中含有次氯酸具有漂白性,可漂白试纸;
B.阳极为粗铜,含有比铜活泼的金属如铁、锌,先失电子;
C.将208 g BaCl2固体溶解在1 L水中,溶液的体积大于1L;
D.水中含有次氯酸具有漂白性,可漂白试纸;
解答:
解:A.500mL 1 mol/LNa2CO3溶液含有碳酸根离子的物质的量=0.5L×1 mol/L=0.5mol,600mL 1 mol/LHCl 含有氢离子的物质的量=0.6L×1 mol/L=0.6mol,
Na2CO3溶液中逐滴滴加盐酸先后发生反应:
CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑,
1 1 1 1 1 1
0.5 0.5 0.5 0.1 0.1 0.1 所以生成二氧化碳的体积为0.1mol,标况下体积=0.1mol×22.4L/mol=2.24L,故A正确;
B.电解精炼铜粗铜做阳极失电子发生氧化反应,精铜做阴极得到电子发生还原反应,若阴极得到2摩尔电子,阳极共失2摩尔电子,阳极电极反应由Cu-2e-=Cu2+,Fe-2e-=Fe2+,Zn-2e-=Zn2+,所以阳极溶解减少的质量不是铜失电子溶解的质量,故B错误;
C.208 g BaCl2固体的物质的量=
=1mol,溶解在1 L水中溶液的体积大于1L,所以溶液的浓度小于1 mol?L-1,故C错误;
D.氯水含有盐酸和次氯酸,可使试纸先变红后褪色,所以不能用pH试纸测量氯水的pH值,故D错误;
故选:A.
Na2CO3溶液中逐滴滴加盐酸先后发生反应:
CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑,
1 1 1 1 1 1
0.5 0.5 0.5 0.1 0.1 0.1 所以生成二氧化碳的体积为0.1mol,标况下体积=0.1mol×22.4L/mol=2.24L,故A正确;
B.电解精炼铜粗铜做阳极失电子发生氧化反应,精铜做阴极得到电子发生还原反应,若阴极得到2摩尔电子,阳极共失2摩尔电子,阳极电极反应由Cu-2e-=Cu2+,Fe-2e-=Fe2+,Zn-2e-=Zn2+,所以阳极溶解减少的质量不是铜失电子溶解的质量,故B错误;
C.208 g BaCl2固体的物质的量=
| 208g |
| 208g/mol |
D.氯水含有盐酸和次氯酸,可使试纸先变红后褪色,所以不能用pH试纸测量氯水的pH值,故D错误;
故选:A.
点评:本题考查了有关方程式的计算、电解法精炼铜、物质的量浓度的概念、氯水的性质,题目综合性强,难度中等,明确物质的性质、电解的原理是解题关键,选项A为易错选项.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
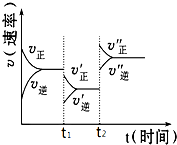 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |
只用下列一种试剂,就能鉴别氢氧化钠、氢氧化钙和稀盐酸三种无色溶液的是( )
| A、酚酞试剂 |
| B、氯化钡溶液 |
| C、紫色石蕊试剂 |
| D、碳酸钠溶液 |
在工业生产中,降低能耗是重要的节能措施.下列说法不符合生产实际的是( )
| A、使用恰当的还原剂,可以在较低的温度下把金属从矿石中提取出来 |
| B、研制出性能优良的催化剂可以使反应温度降低,提高反应速率,从而起到节能效果 |
| C、制水泥、玻璃等硅酸盐工业需要消耗大量能源,我们应通过降低其产量来节能 |
| D、利用铝的还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物 |
下列说法不正确的是( )
| A、氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 |
| B、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |
| C、淀粉、蛋白质、油脂均是天然高分子化合物 |
| D、不慎将苯酚沾到皮肤上应立即用酒精清洗 |
下列有关说法体现了化学与生产、生活、社会的密切关系. 其中不正确的是( )
| A、绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
| B、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| C、停车场安装催化光反应设施,可使汽车尾气中的CO和NOX反应生成无毒气体 |
| D、氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料 |
 磷化硼是一种高折射率红棕色晶体,可通过单质B与Zn3P2(或PH3)反应,也可热解PCl3?BCl3制得.
磷化硼是一种高折射率红棕色晶体,可通过单质B与Zn3P2(或PH3)反应,也可热解PCl3?BCl3制得.