题目内容
在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
(1)该反应的平衡常数表达式为 ;从表中分析:
c1 c2,c3 c4(填“>”、“<”或“=”).
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为 mol?L-1?s-1.
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是 (填字母序号).
A.扩大容器的容积 B.再充入一定量的N2O4C.分离出一定量的NO2 D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080mol NO2气体,则达到平衡时NO2气体的转化率为 .
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol?L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
c1
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是
A.扩大容器的容积 B.再充入一定量的N2O4C.分离出一定量的NO2 D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080mol NO2气体,则达到平衡时NO2气体的转化率为
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:(1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,根据方程式计算c2、c1,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=
计算得到;
(3)依据化学平衡原理分析改变条件提高NO2转化率的选项;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
×100%;
(2)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=
| △c |
| △t |
(3)依据化学平衡原理分析改变条件提高NO2转化率的选项;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
| 消耗量 |
| 起始量 |
解答:
解:(1)N2O4(g)?2NO2(g),反应的平衡常数K=
;
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c1;
故答案为:
;<;=;
(2)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=
=0.001mol/(L?s);
故答案为:0.001;
(3)N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;
A、增大容器体积,各组分浓度均减小,故A错误;
B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确;
C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;
D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故选B;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
=0.36
若起始时充入N02气体0.080mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=
2 NO2=N2O4
起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x
K=
=
x=0.020mol/L
则达到平衡时N02气体的转化率=
×100%=25%,
故答案为:25%.
| [NO2]2 |
| [N2O4] |
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c1;
故答案为:
| [NO2]2 |
| [N2O4] |
(2)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=
| 0.060mol/L |
| 60s |
故答案为:0.001;
(3)N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;
A、增大容器体积,各组分浓度均减小,故A错误;
B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确;
C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;
D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故选B;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
| 0.122 |
| 0.04 |
若起始时充入N02气体0.080mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=
| 1 |
| 0.36 |
2 NO2=N2O4
起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x
K=
| 0.5x |
| (0.080-x)2 |
| 1 |
| 0.36 |
x=0.020mol/L
则达到平衡时N02气体的转化率=
| 0.020 |
| 0.080 |
故答案为:25%.
点评:本题考查化学平衡的有关计算、化学平衡的影响因素,题目综合性较大,注意基础知识的积累掌握.

练习册系列答案
相关题目
下列有关化学用语表达正确的是( )
A、次氯酸的电子式: |
B、CCl4分子的球棍模型: |
| C、乙醛结构简式:CH3CHO |
D、H2O2的电子式: |
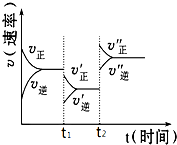 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |
下列物质的水溶液呈碱性的是( )
| A、K2SO4 |
| B、NH4Cl |
| C、Na2CO3 |
| D、H2SO3 |
在做中和热实验测定中和热时,应使用的仪器正确的组合是:( )
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯.
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯.
| A、①③⑥ | B、②③⑤ |
| C、①②③⑥ | D、全部 |
下列说法不正确的是( )
| A、氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 |
| B、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |
| C、淀粉、蛋白质、油脂均是天然高分子化合物 |
| D、不慎将苯酚沾到皮肤上应立即用酒精清洗 |