题目内容
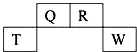 如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A、气态氢化物稳定性:R>Q |
| B、Q与W可形成直线型分子QW2 |
| C、同主族气态氢化物中R的氢化物最稳定,因其分子间存在氢键 |
| D、原子半径:T>W,简单离子半径:T<W |
考点:原子结构与元素周期律的关系
专题:
分析:这几种元素是短周期元素,根据元素在周期表中的位置知,Q、R是第二周期元素,T、W是第三周期元素,四种元素只有一种元素,则只能是T为金属元素,为Al元素,所以Q是C、R是N、W是S元素,
A.元素非金属性越强,其气态氢化物稳定性越强;
B.CS2是直线形分子;
C.气态氢化物的稳定性与非金属性强弱有关,与氢键无关;
D.同一周期元素,原子半径随着原子序数增大而减小,电子层数越多其离子半径越大.
A.元素非金属性越强,其气态氢化物稳定性越强;
B.CS2是直线形分子;
C.气态氢化物的稳定性与非金属性强弱有关,与氢键无关;
D.同一周期元素,原子半径随着原子序数增大而减小,电子层数越多其离子半径越大.
解答:
解:这几种元素是短周期元素,根据元素在周期表中的位置知,Q、R是第二周期元素,T、W是第三周期元素,四种元素只有一种元素,则只能是T为金属元素,为Al元素,所以Q是C、R是N、W是S元素,
A.非金属R>Q,所以气态氢化物的稳定性R>Q,故A正确;
B.CS2是直线形分子,该分子中C原子价层电子对个数是2且不含孤电子对,故B正确;
C.气态氢化物的稳定性与非金属性强弱有关,与氢键无关,氢键只影响物质的物理性质,故C错误;
D.同一周期元素,原子半径随着原子序数增大而减小,电子层数越多其离子半径越大,T离子有两个电子层、W有3个电子层,所以原子半径:T>W,简单离子半径:T<W,故D正确;
故选C.
A.非金属R>Q,所以气态氢化物的稳定性R>Q,故A正确;
B.CS2是直线形分子,该分子中C原子价层电子对个数是2且不含孤电子对,故B正确;
C.气态氢化物的稳定性与非金属性强弱有关,与氢键无关,氢键只影响物质的物理性质,故C错误;
D.同一周期元素,原子半径随着原子序数增大而减小,电子层数越多其离子半径越大,T离子有两个电子层、W有3个电子层,所以原子半径:T>W,简单离子半径:T<W,故D正确;
故选C.
点评:本题侧重考查原子结构、元素周期表结构、元素周期律,熟练掌握原子结构及元素周期律的关系即可解答,

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
向少量FeCl3溶液中滴入KSCN溶液,发生反应:FeCl3+3KSCN?Fe(SCN)3+3KCl.欲使试管内溶液红色变浅,下列措施合理的是( )
①加Fe(SCN)3 ②加NaOH固体 ③加Zn粉 ④加KCl固体.
①加Fe(SCN)3 ②加NaOH固体 ③加Zn粉 ④加KCl固体.
| A、②③ | B、②④ | C、①② | D、①④ |
下列有关化学用语表达正确的是( )
A、次氯酸的电子式: |
B、CCl4分子的球棍模型: |
| C、乙醛结构简式:CH3CHO |
D、H2O2的电子式: |
SiO2是水晶的主要成分,SiO2属于( )
| A、酸 | B、碱 | C、盐 | D、氧化物 |
元素周期表中铋元素的数据见图,下列说法正确的是( )


| A、Bi元素的质量数是209.0 |
| B、Bi元素中子数为83 |
| C、Bi原子6p亚层有有一个未成对电子 |
| D、Bi位于第六周期VA族,属于p区 |
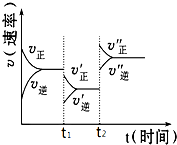 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |
下列物质的水溶液呈碱性的是( )
| A、K2SO4 |
| B、NH4Cl |
| C、Na2CO3 |
| D、H2SO3 |
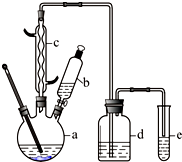 溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应.有关数据如下:
溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应.有关数据如下: