题目内容
14.比较乙烷、乙烯、乙炔的组成、结构和性质,不正确的叙述是( )| A. | 这三种物质都属于气态烃 | |
| B. | 乙炔中碳的质量分数最小 | |
| C. | 溴水能与乙烯和乙炔加成,但不能与乙烷反应 | |
| D. | 一个分子中,共用电子对最多的物质是乙烷 |
分析 A.常温下、烃分子中碳原子数小于等于4的为气体;
B.烃分子中碳的质量分数可以依据CxHy转化为CH$\frac{y}{x}$计算分析,$\frac{y}{x}$越大碳含量越低;
C.乙烯、乙炔分子中含有不饱和碳碳键,和溴水溶液中溴单质能发生加成反应,乙烷是饱和烷烃不能发生加成反应;
D.乙烷分子中形成的化学键都是单键含共用电子对7个,乙烯分子中含一个碳碳双键,乙炔分子中含一个碳碳三键.
解答 解:A.常温下、烃分子中碳原子数小于等于4的为气体,乙烷、乙烯、乙炔都是气体,故A正确;
B.烃分子中碳的质量分数可以依据CxHy转化为CH$\frac{y}{x}$计算分析,$\frac{y}{x}$越大碳含量越低,乙烷、乙烯、乙炔中乙烷中$\frac{y}{x}$大,含碳量最低,乙炔分子中含碳量最高,故B错误;
C.乙烯、乙炔分子中含有不饱和碳碳键,和溴水溶液中溴单质能发生加成反应,乙烷是饱和烷烃不能发生加成反应,故C正确;
D.乙烷分子中形成的化学键都是单键含共用电子对7个,乙烯分子中含一个碳碳双键四个碳氢单键共6个共用电子对,乙炔分子中含一个碳碳三键,两个碳氢键共有共用电子对5个,一个分子中,共用电子对最多的物质是乙烷,故D正确;
故选B.
点评 本题考查了烃类化合物结构特征、含碳量比较、物理性质等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.如表是50mL稀盐酸和1g碳酸钙反应的实验数据:
分析上述数据,回答下列问题:
(1)本反应属于放热反应(填吸热或放热),实验中的所有反应,反应前后溶液的温度变化值相近(约为20℃),推测其原因是反应掉碳酸钙的量相同,放出的热量相同.
(2)实验6和7表明,温度对反应速率有影响,温度越高反应速率
越快,能表明同一规律的实验还有8和9(填实验序号).
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是其它条件一定,反应物浓度越大,反应速率越快.
(4)本实验中影响反应速率的其它因素还有反应物的接触面积,能表明这一规律的实验序号是1、2与4和5.
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
(1)本反应属于放热反应(填吸热或放热),实验中的所有反应,反应前后溶液的温度变化值相近(约为20℃),推测其原因是反应掉碳酸钙的量相同,放出的热量相同.
(2)实验6和7表明,温度对反应速率有影响,温度越高反应速率
越快,能表明同一规律的实验还有8和9(填实验序号).
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是其它条件一定,反应物浓度越大,反应速率越快.
(4)本实验中影响反应速率的其它因素还有反应物的接触面积,能表明这一规律的实验序号是1、2与4和5.
2.白钨矿的主要成分是钨酸钙(CaWO4),其中钨的化合价为( )
| A. | +3 | B. | +4 | C. | +6 | D. | +7 |
19.下列物质不能破坏水的电离平衡的是( )
| A. | NaCl | B. | H2S | C. | Na2S | D. | NH4Cl |
6.双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( )
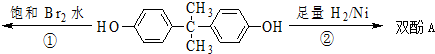

| A. | 双酚A的分子式是C15H16O2 | |
| B. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| C. | 反应①中,1 mol双酚A最多消耗4mol Br2 | |
| D. | 反应②的产物中有两种官能团 |
4.用NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 44gN2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4 L N2含有的分子数目为NA | |
| C. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
 .
.