题目内容
8.科学家最近制得一种物质A,A可看做是烃B中的所有氢原子被烃C中的一价基团取代而得.A不能使Br2的CCl4溶液褪色.A中氢原子被一个氯原子取代只得到一种物质.一定量的C完全燃烧所得的H2O和CO2的物质的量之比为1.25:1.C的同分异构体不超过3种,而C的二溴代物有三种.一定量的B完全燃烧生成的CO2和H2O的物质的量之比为2:1.B的相对分子质量大于26,小于78.试完成下列问题:(1)B的分子式为C4H4.
(2)写出C的结构简式:CH(CH3)3.
(3)A的结构简式为
 .
.
分析 B完全燃烧的产物中n(CO2):n(H2O)=2:1,故B的组成可以表示为(CH)n,由于26<M(A)<78,故26<13n<78,解得2<n<6,B中碳原子个数可能为3,4,5,又烃中氢原子个数为偶数,故B的分子式只能为C4H4;C完全燃烧,所得的H2O和CO2的物质的量之比为 1.25:1,则C中n(C):n(H)=1:2.5,又烃中氢原子个数为偶数,结合烃中氢、碳原子数最大比为(2n+2):n,可知C的分子式为C4H10,是饱和链烃,A可看做是烃B的所有氢原子被烃C的一价基取代而得,A遇Br2的CCl4溶液不褪色,A中的氢原子被一个氯原子取代只能得到一种氯代产物,说明分子中H原子为等效H原子,C的同分异构体不超过3种,而C的二溴代物为3种,所以C为:CH(CH3)3,C的一价烃基为-C(CH3)3,所以A为 ,其分子式为C20H36,以此解答该题.
,其分子式为C20H36,以此解答该题.
解答 解:B完全燃烧的产物中n(CO2):n(H2O)=2:1,故B的组成可以表示为(CH)n,由于26<M(A)<78,故26<13n<78,解得2<n<6,B中碳原子个数可能为3,4,5,又烃中氢原子个数为偶数,故B的分子式只能为C4H4;C完全燃烧,所得的H2O和CO2的物质的量之比为 1.25:1,则C中n(C):n(H)=1:2.5,又烃中氢原子个数为偶数,结合烃中氢、碳原子数最大比为(2n+2):n,可知C的分子式为C4H10,是饱和链烃,A可看做是烃B的所有氢原子被烃C的一价基取代而得,A遇Br2的CCl4溶液不褪色,A中的氢原子被一个氯原子取代只能得到一种氯代产物,说明分子中H原子为等效H原子,C的同分异构体不超过3种,而C的二溴代物为3种,所以C为:CH(CH3)3,C的一价烃基为-C(CH3)3,所以A为 ,其分子式为C20H36,
,其分子式为C20H36,
(1)根据上面的分析可知,B的分子式为C4H4,故答案为:C4H4;
(2)由以上分析可知C为CH(CH3)3,故答案为:CH(CH3)3;
(3)A为 ,故答案为:
,故答案为: .
.
点评 本题考查有机推断,为高考常见题型,题目难度中等,注意掌握常见有机物结构与性质,推断B的分子式为解答本题的关键,试题有利于培养学生灵活应用所学知识的能力及逻辑推理能力.

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )| A. | 用如图1所示装置分离CCl4和水 | |
| B. | 除去苯中的少量苯酚,加入适量浓溴水,过滤 | |
| C. | 实验室用如图2所示装置除去Cl2中的少量HCl | |
| D. | 除去O2中混有得得少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| A. | NaCl | B. | H2S | C. | Na2S | D. | NH4Cl |
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
| CaS04 | Mg2(OH)2C03 | CaC03 | BaS04 | BaC03 |
| 2.6×1 0-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×1 0-3 |
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下:
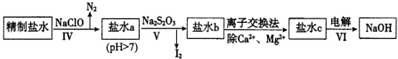
①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
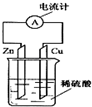 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 该装置将电能转变为化学能 | B. | 电流从锌片经导线流向铜片 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片上发生氧化反应 |
| A. | 食物放在冰箱中会减慢食物变质的速率 | |
| B. | 钾的金属性强,所以钾与水的反应比钠的反应剧烈 | |
| C. | 2mol SO2与1mol O2混合反应后一定能生成2 mol SO3 | |
| D. | 面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸 |
假设、验证:
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3 | (1)在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 | (2)白色浑浊物是BaSO4,主要 原因是Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 | 反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊; (3)通入纯净的CO2的目的防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
(4)写出SO2通入BaCl2、FeCl3的混合溶液生成沉淀相关的离子方程式.
(a)SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
(b)Ba2++SO42-=BaSO4↓.