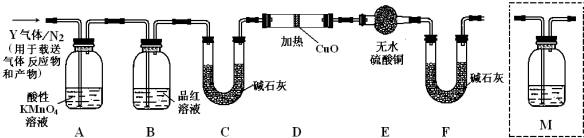
题目内容
6.某溶液中只含有Na2CO3和Na2SO4两种溶质,欲证明其中SO42-、CO32-确实存在,选用的方案是先取少量的原溶液滴加过量的盐酸,发现有无色无味气体生成,再向其中加入氯化钡溶液,出现白色沉淀;再取少量原溶液,加入足量氯化钡溶液,产生白色沉淀,再加入足量盐酸,沉淀部分溶解,则可以证明SO42-、CO32-两种离子的存在.分析 证明其中SO42-、CO32-确实存在,先加盐酸生成气体,硫酸钠与氯化钡反应生成硫酸钡沉淀不溶于盐酸,而碳酸钠与氯化钡反应生成的碳酸钡可溶于盐酸,以此来解答.
解答 解:某溶液中只含有Na2CO3和Na2SO4两种溶质,欲证明其中SO42-、CO32-确实存在,选用的方案是先取少量的原溶液滴加过量的盐酸,发现有无色无味气体生成,再向其中加入氯化钡溶液,出现白色沉淀;再取少量原溶液,加入足量氯化钡溶液,产生白色沉淀,再加入足量盐酸,沉淀部分溶解,则可以证明SO42-、CO32-两种离子的存在,
故答案为:盐酸;氯化钡;氯化钡;盐酸.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、离子反应及现象为解答的关键,侧重分析与实验能力的考查,注意沉淀能否溶于盐酸,题目难度不大.

练习册系列答案
相关题目
14.下列离子方程式的书写正确的是( )
| A. | 误将洁厕灵与消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| C. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
18.关于如图所示装置的叙述,正确的是( )
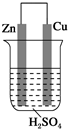

| A. | 铜极质量逐渐减少 | B. | 锌是正极,发生氧化反应 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 阳离子向铜极移动 |
15.如图所示的装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )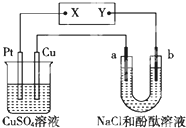

| A. | X是正极,Y是负极 | |
| B. | NaCl溶液中的Cl-移向b极 | |
| C. | CuSO4溶液的pH不变 | |
| D. | 理论上,a和b生成的气体的物质的量之比为1:2 |
17.室温时将浓度和体积分别为 c1、V1的 NaOH 溶液和 c2、V2的 CH3COOH 溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A. | 若 pH>7,则一定是 c1V1═c2V2 | |
| B. | 在任何情况下都是 c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当 pH=7 时,若 V1=V2,则一定是 c1<c2 | |
| D. | 若 V1=V2、c1=c2,则 c(CH3COO-)+c(CH3COOH)═c(Na+) |