题目内容
2.化学与生产、生活、环境密切相关,下列说法中正确的是( )| A. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 | |
| B. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| C. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| D. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 |
分析 A.食盐可使细胞脱水,可杀菌,而次氯酸钠具有强氧化性;
B.N、S的氧化物可导致酸雨发生;
C.Si为常见的半导体材料,二氧化硅对光具有良好的全反射作用;
D.铂、铁灼烧均为无色.
解答 解:A.食盐可使细胞脱水,可杀菌,而次氯酸钠具有强氧化性,可使蛋白质发生变性,二者消毒原理不同,故A错误;
B.N、S的氧化物可导致酸雨发生,则大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生,故B正确;
C.Si为常见的半导体材料,则太阳能电池使用的材枓主要是晶体Si,二氧化硅对光具有良好的全反射作用,则光纤通信使用的光缆的主要成分是SiO2,故C错误;
D.铂、铁灼烧均为无色,而碱金属、锶等金属化合物灼烧具有焰色,故D错误;
故选B.
点评 本题考查较综合,涉及物质的性质及应用、三废处理及环境保护,为高频考点,把握物质的性质、性质与用途、环境与保护为解答的关键,侧重分析与应用能力的考查,注意化学与环境的联系,题目难度不大.

练习册系列答案
相关题目
18.SO2不具有的性质是( )
| A. | 碱性 | B. | 还原性 | C. | 氧化性 | D. | 漂白性 |
13.某学习小组对硫代硫酸钠的相关性质进行探究.
Ⅰ通过硫代硫酸钠与硫酸反应的有关实验,研究反应速率的影响因素,实验过程数据记录如下.
(1)硫代硫酸钠与硫酸反应的离子方程式是S2O32-+2H+═S↓+SO2↑+H2O.
(2)A和B的组合比较,所研究的问题是温度对化学反应速率的影响.
(3)在上述实验中,反应速率最慢的是(填实验序号)C.
Ⅱ对Na2S2O3的其他部分性质进行了理论预测以及实验探究(反应均在溶液中进行).
(4)探究①中进行的实验操作是取pH试纸于玻璃片上,用玻璃棒蘸取硫代硫酸钠于pH试纸的中部,将试纸颜色与标准比色卡对照.
(5)产生探究②中的现象的原因是(用离子方程式表示)S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
Ⅲ查阅资料发现,在照片冲印过程中,要将曝光后的底片浸泡在过量Na2S2O3溶液中,Na2S2O3可以和涂在胶片上的Ag+反应形成可溶性的无色离子[Ag(S2O3)2]3-,从而起到定影的作用.
该组同学想验证这一过程,于是A同学将Na2S2O3溶液滴至AgNO3溶液中,发现立即生成白色沉淀,他马上停止了实验.一段时间后,发现沉淀逐渐变为黑色,过滤.他认为黑色物质可能是Ag2O或Ag2S.
B同学在A同学分析、实验的基础上分析过滤所得滤液,发现滤液中除含未反应完的AgNO3外,只含有少量Na+和SO42-.
(6)B同学认为根据以上分析,即能判断黑色物质是Ag2S.请简述B同学做出如上判断的理由是溶液中有SO42-,说明有硫元素升价,所以体系中必须有元素降价.若生成Ag2O,体系中无元素降价;所以只能是有一部分硫元素降为-2价,生成Ag2S..
(7)A同学未能验证定影过程的原因可能是定影过程要求将Ag+与过量Na2S2O3溶液反应生成可溶性的无色离子[Ag(S2O3)2]3-(Na2S2O3过量,而A同学将Na2S2O3溶液滴至AgNO3溶液中(AgNO3过量),由于反应物的比例关系不同,因此反应现象不同.
Ⅰ通过硫代硫酸钠与硫酸反应的有关实验,研究反应速率的影响因素,实验过程数据记录如下.
实验序号 | 反应温度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/(mol•L-1) | V/ml | c/(mol•L-1) | V/ml | ||
| A | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 5 | 0.1 | 5 | 0.1 | 10 |
(2)A和B的组合比较,所研究的问题是温度对化学反应速率的影响.
(3)在上述实验中,反应速率最慢的是(填实验序号)C.
Ⅱ对Na2S2O3的其他部分性质进行了理论预测以及实验探究(反应均在溶液中进行).
| 预测 | 实验操作 | 实验现象 | ?现象解释 | |
| 探究① | Na2S2O3溶液呈碱性 | 溶液pH=8 | S2O32-+H2O HS2O3-+OH- | |
| 探究② | Na2S2O3有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 氯水颜色变浅 |
(5)产生探究②中的现象的原因是(用离子方程式表示)S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
Ⅲ查阅资料发现,在照片冲印过程中,要将曝光后的底片浸泡在过量Na2S2O3溶液中,Na2S2O3可以和涂在胶片上的Ag+反应形成可溶性的无色离子[Ag(S2O3)2]3-,从而起到定影的作用.
该组同学想验证这一过程,于是A同学将Na2S2O3溶液滴至AgNO3溶液中,发现立即生成白色沉淀,他马上停止了实验.一段时间后,发现沉淀逐渐变为黑色,过滤.他认为黑色物质可能是Ag2O或Ag2S.
B同学在A同学分析、实验的基础上分析过滤所得滤液,发现滤液中除含未反应完的AgNO3外,只含有少量Na+和SO42-.
(6)B同学认为根据以上分析,即能判断黑色物质是Ag2S.请简述B同学做出如上判断的理由是溶液中有SO42-,说明有硫元素升价,所以体系中必须有元素降价.若生成Ag2O,体系中无元素降价;所以只能是有一部分硫元素降为-2价,生成Ag2S..
(7)A同学未能验证定影过程的原因可能是定影过程要求将Ag+与过量Na2S2O3溶液反应生成可溶性的无色离子[Ag(S2O3)2]3-(Na2S2O3过量,而A同学将Na2S2O3溶液滴至AgNO3溶液中(AgNO3过量),由于反应物的比例关系不同,因此反应现象不同.
17. 实验室测定常温下l molH2的体积通常用如图所示的装置.
实验室测定常温下l molH2的体积通常用如图所示的装置.
实验记录:温度15℃压强1大气压
(1)求得的平均Vm=23.515L/mol;
(2)实验的相对误差为:0.49%%(已知:15℃时Vm的理论值为:Vm=23.631L/mol).
 实验室测定常温下l molH2的体积通常用如图所示的装置.
实验室测定常温下l molH2的体积通常用如图所示的装置.实验记录:温度15℃压强1大气压
| 实验次数 | 镁带质量(g) | 硫酸体积( mL) | 氢气体积( mL) | l摩尔气体的体积(L)(精确到0.001L) |
| 1 | 0.050 | 10 | 49.0 | |
| 2 | 0.049 | 10 | 48.0 |
(2)实验的相对误差为:0.49%%(已知:15℃时Vm的理论值为:Vm=23.631L/mol).
14.化学与生活密切相关,下列说法中正确的是( )
| A. | 合成纤维和光导纤维都是新型有机非金属材料 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | “玉不琢不成器”、“百炼方能成钢”发生的均为化学变化 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
11.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 乙烯能与高锰酸钾发生氧化还原反应 |
| B | 用Na2S除去废水中的Cu2+和Hg2+ | Na2S具有强还原性 |
| C | 用氧化铁制作红色涂料 | 氧化铁能与酸反应 |
| D | 用明矾溶液清除铜镜表面的铜锈 | 明矾溶液中Al3+能与铜锈反应 |
| A. | A | B. | B | C. | C | D. | D |
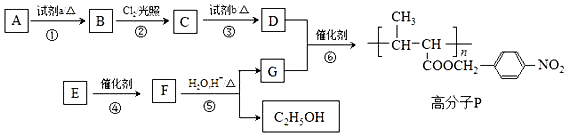
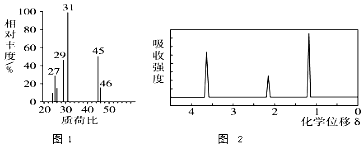
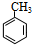 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$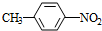 +H2O.
+H2O.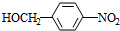 +
+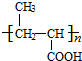 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +nH2O.
+nH2O.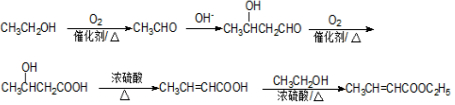 .
. )可由下列方法合成:
)可由下列方法合成:
 .B→C反应方程式为
.B→C反应方程式为 .
. ,
, .
. .
.