题目内容
17. 实验室测定常温下l molH2的体积通常用如图所示的装置.
实验室测定常温下l molH2的体积通常用如图所示的装置.实验记录:温度15℃压强1大气压
| 实验次数 | 镁带质量(g) | 硫酸体积( mL) | 氢气体积( mL) | l摩尔气体的体积(L)(精确到0.001L) |
| 1 | 0.050 | 10 | 49.0 | |
| 2 | 0.049 | 10 | 48.0 |
(2)实验的相对误差为:0.49%%(已知:15℃时Vm的理论值为:Vm=23.631L/mol).
分析 (1)实验1测定体积为49mL,计算得到1mol氢气的体积=$\frac{0.049L×24g/mol}{0.050g}$×1mol=23.52L;
实验2测定氢气的体积=48mL,计算得到1mol氢气的体积=$\frac{0.048L×24g/mol}{0.049g}$×1mol=23.51L;然后求出 平均Vm;
(2)实验误差=$\frac{实验值-理论值}{理论值}$×100%,据此计算.
解答 解:(1)实验1测定体积为49mL,计算得到1mol氢气的体积=$\frac{0.049L×24g/mol}{0.050g}$×1mol=23.52L;
实验2测定氢气的体积=48mL,计算得到1mol氢气的体积=$\frac{0.048L×24g/mol}{0.049g}$×1mol=23.51L;两次测定的平均值=$\frac{23.52+23.51}{2}$=23.515L,所以平均Vm=23.515L/mol,
故答案为:23.515;
(2)实验误差=$\frac{实验值-理论值}{理论值}$×100%=$\frac{23.631-23.515}{23.631}$×100%=0.49%;
故答案为:0.49%.
点评 本题考查了气体摩尔体积的计算,题目难度中等,注意把握气体摩尔体积的计算方法以及实验的相对误差的计算方法,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
13.某化学电源的工作原理如图.下列说法不正确的是( )
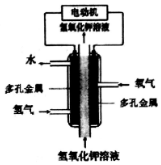

| A. | 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力 | |
| B. | 通H2的电极作负极,发生氧化反应 | |
| C. | 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O | |
| D. | 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能 |
12.关于废旧物资再生与综合利用的措施中,合理的是( )
| A. | 将废弃的聚乙烯泡沫直接填埋 | B. | 焚烧废旧电脑器件回收金属 | ||
| C. | 生活垃圾直接作为饲料喂养家畜 | D. | 废弃农作物发酵制备沼气 |
2.化学与生产、生活、环境密切相关,下列说法中正确的是( )
| A. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 | |
| B. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| C. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| D. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 |
7.下列关于有机物的叙述正确的是( )
| A. | 石油干馏可得到汽油、煤油等 | |
| B. | 苯不能使酸性KmnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 淀粉、蛋白质完全水解的产物互为同分异构体 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |

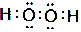 ;YW2分子形状为直线形.
;YW2分子形状为直线形.