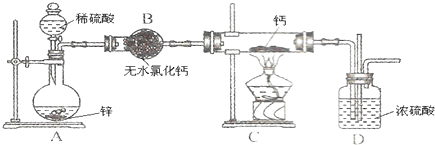
题目内容
18.SO2不具有的性质是( )| A. | 碱性 | B. | 还原性 | C. | 氧化性 | D. | 漂白性 |
分析 二氧化硫为酸性氧化物,可与水、碱以及碱性氧化物反应,S元素化合价为+4价,处于中间价态,既具有氧化性也具有还原性,另外还具有漂白性,以此解答.
解答 解:二氧化硫为无色、具有刺激性气味的气体,可与水、碱以及碱性氧化物反应,具有漂白性、氧化性和还原性,可形成酸雨,只有A错误,故选A.
点评 本题考查二氧化硫的性质,为高频考点,侧重于双基的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
8.常温下,已知Ksp(AgCl)>Ksp( AgBr),现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,下列有关说法不正确的是( )
| A. | 根据Ksp(AgCl)>Ksp( AgBr),可知AgCl的溶解能力比AgBr强 | |
| B. | 加入足量浓AgNO3溶液后,AgCl和AgBr的溶度积Ksp均不变 | |
| C. | 加入足量浓AgNO3溶液后,溶液中只有AgBr沉淀 | |
| D. | 在含有AgBr、AgCl固体的悬浊液中,c (Cl-)>c (Br-) |
6.下列物质不能通过化合反应得到的是( )
| A. | H2SiO3 | B. | FeCl3 | C. | NaHCO3 | D. | Fe3O4 |
13.某化学电源的工作原理如图.下列说法不正确的是( )
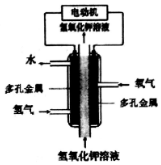

| A. | 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力 | |
| B. | 通H2的电极作负极,发生氧化反应 | |
| C. | 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O | |
| D. | 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能 |
3.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,46 gNO2与N2O4的混合气体中含有的分子总数为NA | |
| B. | 常温常压下,将0.1molFe投人足量的浓硝酸中,转移的电子数为0.3NA | |
| C. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA |
10.下列过程对应的离子方程式正确的是( )
| A. | 碳酸钠溶于水中:CO32-+2H2O?H2CO3+2OH- | |
| B. | 硫酸氢铵与少量氢氧化钠溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氯化铝溶液中滴入过量浓氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 酸性高锰酸钾溶液与草酸溶液混合:5H2C2O4+6H++2MnO4-═2Mn2++10CO2↑+8H2O |
2.化学与生产、生活、环境密切相关,下列说法中正确的是( )
| A. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 | |
| B. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| C. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| D. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 |

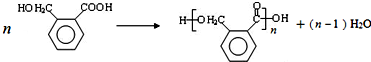 .
. (填结构简式).
(填结构简式). .
.