题目内容
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为沉淀可能是CuCO3; 乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ、(1)按照甲同学的观点,发生反应的离子反应方程式为 ;
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是 .
Ⅱ、请用如图所示装置,选择必要的试剂,定性探究生成物的成分.
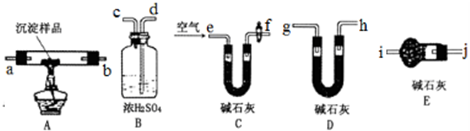
(1)各装置连接顺序为 → → .
(2)能证明生成物中有CuCO3的实验现象是 .
Ⅲ、若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成.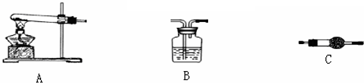
(1)装置C中碱石灰的作用是 .
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为 .
Ⅰ、(1)按照甲同学的观点,发生反应的离子反应方程式为
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是
Ⅱ、请用如图所示装置,选择必要的试剂,定性探究生成物的成分.

(1)各装置连接顺序为
(2)能证明生成物中有CuCO3的实验现象是
Ⅲ、若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成.

(1)装置C中碱石灰的作用是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:Ⅰ、(1)沉淀是CuCO3说明,Na2CO3溶液与CuSO4溶液发生反应生成硫酸钠与碳酸铜,即碳酸根与铜离子反应生成碳酸铜沉淀,反应离子方程式为CO32-+Cu2+=CuCO3↓;
(2)由于碳酸铜沉淀是Na2CO3溶液与CuSO4溶液发生反应生成的,故表面会残留有硫酸根的杂质离子,所以检验最后一次洗涤液中是否含有硫酸根离子即可;
Ⅱ、(1)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳;
(2)用澄清的石灰水检验是否产生二氧化碳,说明含有CuCO3;
Ⅲ、(1)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差;
(2)装置B质量增加了n克,说明分解生成ng水,水的物质的量为
mol,根据氢元素守恒可知氢氧化铜的物质的量为
mol,故氢氧化铜的质量为
mol×98g/mol=
g,沉淀中CuCO3的质量分数为
×100%=(1-
)×100%.
(2)由于碳酸铜沉淀是Na2CO3溶液与CuSO4溶液发生反应生成的,故表面会残留有硫酸根的杂质离子,所以检验最后一次洗涤液中是否含有硫酸根离子即可;
Ⅱ、(1)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳;
(2)用澄清的石灰水检验是否产生二氧化碳,说明含有CuCO3;
Ⅲ、(1)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差;
(2)装置B质量增加了n克,说明分解生成ng水,水的物质的量为
| n |
| 18 |
| n |
| 18 |
| n |
| 18 |
| 49n |
| 9 |
mg-
| ||
| mg |
| 49n |
| 9m |
解答:
解:Ⅰ、(1)沉淀是CuCO3说明,Na2CO3溶液与CuSO4溶液发生反应生成硫酸钠与碳酸铜,即碳酸根与铜离子反应生成碳酸铜沉淀,反应离子方程式为CO32-+Cu2+=CuCO3↓,故答案为:CO32-+Cu2+=CuCO3↓;
(2)由于碳酸铜沉淀是Na2CO3溶液与CuSO4溶液发生反应生成的,故表面会残留有硫酸根的杂质离子,所取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净,故答案为:取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净;
Ⅱ、(1)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳.
故答案为:A;C;B;
(2)用澄清的石灰水检验是否产生二氧化碳,装置B中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3,故答案为:装置B中澄清石灰水变混浊;
Ⅲ、(1)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除,故装置C中碱石灰的作用是吸收空气中的H2O 蒸汽和CO2,故答案为:吸收空气中的H2O 蒸汽和CO2;
(2)装置B质量增加了n克,说明分解生成ng水,水的物质的量为
mol,根据氢元素守恒可知氢氧化铜的物质的量为
mol,故氢氧化铜的质量为
mol×98g/mol=
g,沉淀中CuCO3的质量分数为
×100%=(1-
)×100%,
故答案为=(1-
)×100%.
(2)由于碳酸铜沉淀是Na2CO3溶液与CuSO4溶液发生反应生成的,故表面会残留有硫酸根的杂质离子,所取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净,故答案为:取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净;
Ⅱ、(1)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳.
故答案为:A;C;B;
(2)用澄清的石灰水检验是否产生二氧化碳,装置B中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3,故答案为:装置B中澄清石灰水变混浊;
Ⅲ、(1)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除,故装置C中碱石灰的作用是吸收空气中的H2O 蒸汽和CO2,故答案为:吸收空气中的H2O 蒸汽和CO2;
(2)装置B质量增加了n克,说明分解生成ng水,水的物质的量为
| n |
| 18 |
| n |
| 18 |
| n |
| 18 |
| 49n |
| 9 |
mg-
| ||
| mg |
| 49n |
| 9m |
故答案为=(1-
| 49n |
| 9m |
点评:本题考查了物质组成的实验分析应用,实验设计和步骤理解应用是解题关键,掌握基础是关键,题目难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,B元素的原子核内质子数等于中子数,下列叙述不正确的是( )
| B | ||
| A | C |
| A、A为ⅤA族元素 |
| B、B为第二周期的元素 |
| C、C是周期表中化学性质最活泼的非金属 |
| D、三种元素都为非金属元素 |

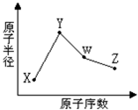 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.