题目内容
某工厂废水显酸性,含氢离子(H+)浓度约为0.1mol/L,现欲采用0.1mol/L的NaOH标准液滴定废水的方法测定其氢离子的准确浓度,每次取废水25.00mL进行滴定.(已知:除H+以外的其它成分均不与NaOH反应)
①为配制本次实验的标准液需称取NaOH固体 g;
②配制标准液有以下实验步骤(只有名称):
A.计算 B.溶解 C.转移 D.称量 E.洗涤 F.定容 G.冷却 H.摇匀
其正确的操作顺序为 ;
③滴定要用到的主要仪器有 ;
④滴定结束后,对相关数据进行处理得知平均每次滴定消耗标准液24.60mL,则该工厂废水中含氢离子的浓度为 mol/L(保留三位有效数字).
⑤下列操作将会造成最终实验结果偏高的是( )
A.制标准液称取NaOH固体时所用砝码生锈
B.实验过程中发现盛装标准液的滴定管尖嘴内有气泡,结束时气泡不见了
C.盛装标准液的滴定管未用标准液润洗直接装标准液
D.给装标准液的滴定管读数时滴定前仰视,滴定后俯视.
①为配制本次实验的标准液需称取NaOH固体
②配制标准液有以下实验步骤(只有名称):
A.计算 B.溶解 C.转移 D.称量 E.洗涤 F.定容 G.冷却 H.摇匀
其正确的操作顺序为
③滴定要用到的主要仪器有
④滴定结束后,对相关数据进行处理得知平均每次滴定消耗标准液24.60mL,则该工厂废水中含氢离子的浓度为
⑤下列操作将会造成最终实验结果偏高的是(
A.制标准液称取NaOH固体时所用砝码生锈
B.实验过程中发现盛装标准液的滴定管尖嘴内有气泡,结束时气泡不见了
C.盛装标准液的滴定管未用标准液润洗直接装标准液
D.给装标准液的滴定管读数时滴定前仰视,滴定后俯视.
考点:中和滴定
专题:实验题
分析:①用0.1mol/L的NaOH,一般要滴定三次,所以配制100ml溶液即可,据此计算氢氧化钠的质量;
②根据配制溶液的实验操作分析;
③根据滴定实验的操作分析,量取标准溶液,量取待测溶液,待测溶液转入锥形瓶,加指示剂,滴定;
④根据c(标准)×V(标准)=c(待测)×V(待测) 计算;
⑤根据计算公式分析操作对标准溶液体积的影响,结合计算公式分析.
②根据配制溶液的实验操作分析;
③根据滴定实验的操作分析,量取标准溶液,量取待测溶液,待测溶液转入锥形瓶,加指示剂,滴定;
④根据c(标准)×V(标准)=c(待测)×V(待测) 计算;
⑤根据计算公式分析操作对标准溶液体积的影响,结合计算公式分析.
解答:
解:①用0.1mol/L的NaOH,一般要滴定三次,所以配制100ml溶液即可,则氢氧化钠的物质的量为n=cV=0.1mol/L×0.1L=0.01mol,所以氢氧化钠的质量为0.01mol×40g/mol=0.4g;
故答案为:0.4;
②配制标准液有以下实验步骤为:计算、称量氢氧化钠的质量、溶解、冷却至室温、把溶液转移到容量瓶中、洗涤烧杯和玻璃棒、定容、最后摇匀,即操作顺序为:A D B G C E F H;
故答案为:A D B G C E F H;
③滴定实验的操作:先检验滴定管是否漏水,洗涤滴定管,然后用碱式滴定管量取标准溶液,用滴定管夹把滴定管固定在铁架台上,用酸式滴定管量取待测溶液,把待测溶液转入锥形瓶,加几滴指示剂,然后滴定,所以实验中用到的主要仪器为:酸式滴定管、碱式滴定管、滴定管夹、锥形瓶、铁架台;
故答案为:酸式滴定管、碱式滴定管、滴定管夹、锥形瓶、铁架台;
④c(标准)×V(标准)=c(待测)×V(待测),则c(H+)=
=
=0.0984 mol/L;
故答案为:0.0984;
⑤计算公式为c(H+)=
,
A.制标准液称取NaOH固体时所用砝码生锈,则称量的氢氧化钠的质量偏大,则氢氧化钠的浓度偏大,滴定时消耗的氢氧化钠的体积偏小,则计算得到的氢离子的浓度偏小,故A不选;
B.实验过程中发现盛装标准液的滴定管尖嘴内有气泡,结束时气泡不见了,则在滴定管上读到的数据偏大,即氢氧化钠的体积偏大,则计算结果偏高,故B选;
C.盛装标准液的滴定管未用标准液润洗直接装标准液,则氢氧化钠的浓度减小,滴定时消耗的氢氧化钠的体积偏大,则计算结果偏高,故C选;
D.给装标准液的滴定管读数时滴定前仰视,滴定后俯视,则读出的氢氧化钠的体积偏小,所以测得的氢离子的浓度偏小,故D不选;
故答案为:BC.
故答案为:0.4;
②配制标准液有以下实验步骤为:计算、称量氢氧化钠的质量、溶解、冷却至室温、把溶液转移到容量瓶中、洗涤烧杯和玻璃棒、定容、最后摇匀,即操作顺序为:A D B G C E F H;
故答案为:A D B G C E F H;
③滴定实验的操作:先检验滴定管是否漏水,洗涤滴定管,然后用碱式滴定管量取标准溶液,用滴定管夹把滴定管固定在铁架台上,用酸式滴定管量取待测溶液,把待测溶液转入锥形瓶,加几滴指示剂,然后滴定,所以实验中用到的主要仪器为:酸式滴定管、碱式滴定管、滴定管夹、锥形瓶、铁架台;
故答案为:酸式滴定管、碱式滴定管、滴定管夹、锥形瓶、铁架台;
④c(标准)×V(标准)=c(待测)×V(待测),则c(H+)=
| c(NaOH)×V(NaOH) |
| c(H+) |
| 0.1mol/L×0.0246L |
| 0.025L |
故答案为:0.0984;
⑤计算公式为c(H+)=
| c(NaOH)×V(NaOH) |
| c(H+) |
A.制标准液称取NaOH固体时所用砝码生锈,则称量的氢氧化钠的质量偏大,则氢氧化钠的浓度偏大,滴定时消耗的氢氧化钠的体积偏小,则计算得到的氢离子的浓度偏小,故A不选;
B.实验过程中发现盛装标准液的滴定管尖嘴内有气泡,结束时气泡不见了,则在滴定管上读到的数据偏大,即氢氧化钠的体积偏大,则计算结果偏高,故B选;
C.盛装标准液的滴定管未用标准液润洗直接装标准液,则氢氧化钠的浓度减小,滴定时消耗的氢氧化钠的体积偏大,则计算结果偏高,故C选;
D.给装标准液的滴定管读数时滴定前仰视,滴定后俯视,则读出的氢氧化钠的体积偏小,所以测得的氢离子的浓度偏小,故D不选;
故答案为:BC.
点评:本题考查了溶液的配制、中和滴定实验,题目难度适中,侧重于考查学生的实验能力和数据处理能力,注意根据计算公式来分析中和滴定中的误差.

练习册系列答案
相关题目
根据下面的物质转换图,下列说法不正确的是( )
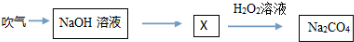

| A、Na2CO4是一种盐,其中碳为+6价 |
| B、X溶液中可能含两种盐 |
| C、该过程中没有发生氧化还原反应 |
| D、NaHCO3与盐酸和氢氧化钠均能反应 |
下列反应的离子方程式书写正确的是( )
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═H2O+BaCO3↓ |
| C、NaHCO3溶液和过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+═BaCO3↓+2H2O+CO32- |
| D、NaAlO2溶液中通入少量CO2:2A1O2-+CO2+3H2O═2Al(OH)3↓+CO32- |





 ,物质E含2个六元环.
,物质E含2个六元环.

 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.