题目内容
根据以下实验,推断A、B、C、D各是什么物质.
A. ;B. ;C. ;D. .

A.
考点:无机物的推断
专题:推断题
分析:分析流程图可知红褐色沉淀D为Fe(OH)3,溶液B为FeCl2,A为Fe,溶液B加入的碱为KOH,所以,C为KCl,据此分析判断.
解答:
解:分析流程图可知,红褐色沉淀D为Fe(OH)3,溶液B为FeCl2,A为Fe,溶液焰色反应为紫色说明含有钾元素,溶液B加入的碱为KOH,反应生成白色沉淀为Fe(OH)2和KCl,所以C为KCl;
故答案为:Fe,FeCl2,KCl,Fe(OH)3;
故答案为:Fe,FeCl2,KCl,Fe(OH)3;
点评:本题考查了物质性质的分析判断,反应特征现象和物质特征性质,转化关系是解题关键,题目较简单.

练习册系列答案
相关题目
常温下,往H2O2溶液滴加少量FeSO4溶液,可发生如下两个反应:下列说法正确的是 ( )
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe3++H2O2=2Fe2++O2↑+2H+.
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe3++H2O2=2Fe2++O2↑+2H+.
| A、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B、在H2O2分解过程中,溶液的H+浓度逐渐下降 |
| C、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| D、H2O2生产过程中往往需要加入少量Fe2+以提高产率 |
某研究性小组讨论甲乙丙丁四种仪器的用法,其中合理的是( )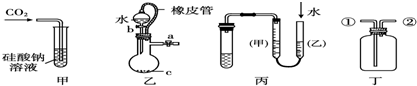

| A、甲装置:可用来证明碳酸的酸性比硅酸强 |
| B、乙装置:c为二氧化硅可制硅酸 |
| C、丙装置:可进行氢氟酸与二氧化硅的反应并测定气体体积 |
| D、丁装置:从②口进气可用于收集二氧化碳 |
检验溶液中是否含有某种离子,下列操作方法正确的是( )
| A、向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- |
| B、向某溶液中加稀 HCl,无明显现象,再加入BaCl2 溶液产生白色沉淀,证明有SO42- |
| C、向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO32- |
| D、加浓氢氧化钠溶液后加热,产生使湿润蓝色石蕊试纸变红的气体,证明含有NH4+ |