题目内容
12.下列有关离子浓度大小比较正确的是( )| A. | 物质的量浓度均为0.1 mol•L-1的下列四种物质的溶液:①NaAlO2,②CH3COONa,③NaHCO3,pH由大到小的顺序是①③② | |
| B. | 等pH的①(NH4)2SO4,②NH4HSO4、③NH4Cl,NH4+浓度由大到小的顺序是①③② | |
| C. | 等浓度的①NH4Al(SO4)2、②(NH4)2CO3、③(NH4)2Fe(SO4)2,NH4+浓度由大到小的顺序是②③① | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①0.1 mol•L-1盐酸、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1硝酸银溶液中,Ag+浓度由大到小的顺序是③②① |
分析 A.物质的量浓度相同的这几种钠盐,弱酸根离子水解程度越大,该盐溶液pH越大;
B.氯化铵和硫酸铵中铵根离子水解程度相同,氢离子抑制铵根离子水解;
C.铝离子、亚铁离子抑制铵根离子水解,碳酸根离子促进铵根离子水解;
D.含有氯离子、银离子的溶液都抑制AgCl溶解,但硝酸银是可溶性物质.
解答 解:A.物质的量浓度相同的这几种钠盐,弱酸根离子水解程度越大,该盐溶液pH越大,酸根离子水解程度AlO2->HCO3->CH3COO-,所以物质的量浓度均为0.1 mol•L-1的下列四种物质的溶液:①NaAlO2,②CH3COONa,③NaHCO3,pH由大到小的顺序是①③②,故A正确;
B.氯化铵和硫酸铵中铵根离子水解程度相同,氢离子抑制铵根离子水解,但硫酸铵化学式中铵根离子个数是氯化铵的2倍,所以等pH的①(NH4)2SO4,②NH4HSO4、③NH4Cl,NH4+浓度由大到小的顺序是③①②,故B错误;
C.铝离子、亚铁离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,但③化学式中铵根离子个数是①的2倍,所以等浓度的①NH4Al(SO4)2、②(NH4)2CO3、③(NH4)2Fe(SO4)2,NH4+浓度由大到小的顺序是③②①,故C错误;
D.含有氯离子、银离子的溶液都抑制AgCl溶解,但硝酸银是可溶性物质,②中氯离子浓度大于①且二者抑制AgCl溶解,所以Ag+浓度由大到小的顺序是③①②,故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确离子之间是促进还是抑制水解、酸根离子水解大小是解本题关键,易错选项是D,注意硝酸银抑制AgCl水解但硝酸银是可溶性盐,则该溶液中银离子浓度最大,题目难度中等.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
20.中药狼把草的成分之一M具有清炎杀菌作用,M的结构如图所示下列叙述正确的是( )

| A. | M的摩尔质量是178 | |
| B. | 1 mol M最多能与2mol Br2发生反应 | |
| C. | 1mol M与足量NaHCO3反应能生成2 mol CO2 | |
| D. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
7.下列说法中错误的是( )
①化学性质相似的有机物是同系物;
②分子组成相差一个或若干个CH2原子团的有机物是同系物;
③若烃中碳、氢元素的质量分数相同,它们必定是同系物;
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似;
⑤相对分子质量相同而结构不同的有机物互为同分异构体;
⑥石墨与金刚石分子式相同,结构不同,互为同分异构体.
①化学性质相似的有机物是同系物;
②分子组成相差一个或若干个CH2原子团的有机物是同系物;
③若烃中碳、氢元素的质量分数相同,它们必定是同系物;
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似;
⑤相对分子质量相同而结构不同的有机物互为同分异构体;
⑥石墨与金刚石分子式相同,结构不同,互为同分异构体.
| A. | ①②③④⑤⑥ | B. | 只有②③⑤ | C. | 只有①③④⑥ | D. | 只有①②③⑤ |
17.如图所示,a、b都是惰性电极,通电一段时间后,a极附近溶液显红色.下列说法中正确的是( )


| A. | CuSO4溶液的n(SO42-)保持不变 | B. | U型管中溶液pH值逐渐变小 | ||
| C. | CuSO4溶液的c(Cu2+)逐渐减小 | D. | X是正极,Y是负极 |
4.某卤代烷烃C5H11Cl发生消去反应时,可以得到两种烯烃,则该卤代烷烃的结构简式可能为( )
| A. | CH3CH2CH2CH2Cl | B. | CH3CH2-CHCl-CH2CH3 | ||
| C. | CH3-CHCl-CH2CH2CH3 | D. | (CH3)3CCH2Cl |
 .合成M的一种途径如下:
.合成M的一种途径如下:

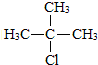 ,D的官能团名为羧基.
,D的官能团名为羧基. .
.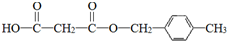 .
.
 ;
; CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.