题目内容
19.由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出2.24L(标准状况)气体时,H2SO4恰好完全消耗.求:(1)反应中消耗的锌的质量是多少?(Zn:65)
(2)有多少个电子通过了导线?
分析 该原电池中,锌电极上电极反应式为Zn-2e-=Zn2+,铜电极上电极反应式为2H++2e-=H2↑,则电池总反应式为Zn+2H+=H2↑+Zn2+,
(1)根据反电池总反应式计算Zn的质量;
(2)根据H元素化合价变化计算转移电子;
解答 解:该原电池中,锌电极上电极反应式为Zn-2e-=Zn2+,铜电极上电极反应式为2H++2e-=H2↑,则电池总反应式为Zn+2H+=H2↑+Zn2+,生成氢气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
(1)由方程式可知,n(Zn)=n(H2)=0.1mol,故消耗Zn的质量为0.1mol×65g/mol=6.5g,答:反应中消耗的锌的质量是6.5g;
(2)转移电子数目为0.1mol×2×[0-(-1)]×6.02×1023mol-1=6.02×1022,答:有6.02×1022个电子通过了导线.
点评 本题以原电池原理为载体,考查方程式的有关计算,题目难度不大,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内生成nmolA的同时生成3nmol的B | |
| C. | A,B,C三种物质的浓度相等 | |
| D. | A,B,C的物质的量之比为1:3:2 |
7.下列实验能够成功的是( )
| A. | 只用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种物质 | |
| B. | 将乙醇加热到170℃可制得乙烯 | |
| C. | 用乙醇、冰醋酸及pH=0的硫酸加热可制乙酸乙酯 | |
| D. | 用酚酞可鉴别苯酚钠和乙醇钠两种溶液 |
20.下列叙述正确的是( )
| A. | NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 | |
| B. | CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心 | |
| C. | H2O是极性分子,分子中O原子和2个H原子不在一条直线上 | |
| D. | CO2是非极性分子,分子中C原子和2个O原子不在一条直线上 |
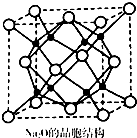 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题: ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷 .
. +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O
+3H2O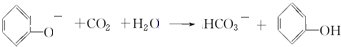 .
.