题目内容
11.填表:| 发展阶段 | 原子结构模型 | 重要科学家 |
| 1 | 近代原子论 | |
| 2 | 汤姆生 | |
| 3 | 原子行星模型 |
分析 1808年,英国科学家道尔顿提出了原子论,他认为物质是由原子直接构成的,原子是一个实心球体,不可再分割,创立了近现代原子论;1897年,英国科学家汤姆生发现原子中存在电子.1904年汤姆生提出了葡萄干面包原子模型,1911年,英国科学家卢瑟福通过a散射,提出了原子结构的行星模型,1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点.
解答 解:在原子结构的探索过程中,1808年,英国科学家道尔顿提出了原子论,他认为物质是由原子直接构成的,原子是一个实心球体,不可再分割,创立了近现代原子论;1897年,英国科学家汤姆生发现原子中存在电子.1904年汤姆生提出了葡萄干面包原子模型,1911年,英国科学家卢瑟福通过a散射,提出了原子结构的行星模型,1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型,
故答案为:
| 发展阶段 | 原子结构模型 | 重要科学家 |
| 1 | 近代原子论 | 道尔顿 |
| 2 | 葡萄干面包模型 | 汤姆生 |
| 3 | 原子行星模型 | 卢瑟福 |
点评 本题考查了原子的结构和化学史,题目难度不大,注意基础知识的积累.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
1.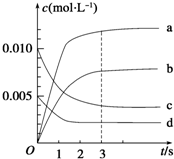 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
(1)能说明该反应已经达到平衡状态的是bc
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是b,
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是ac
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是b,
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是ac
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
2.已知下列反应,其中必须加入氧化剂才能实现的是( )
| A. | CaCO3→CO2 | B. | Cl2→HClO | C. | Na→Na+ | D. | Fe3+→Fe2+ |
19.表是四种盐在不同温度下的溶解度(g/100g水):
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:
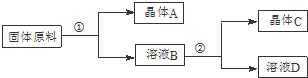
(1)在①和②的实验过程中,需要控制的关键的实验条件是控制温度,在上述晶体中,C(填“A”或“C”)应为硝酸钾晶体.
(2)在①的实验过程中,需要进行的操作依次是加水溶解、蒸发浓缩、趁热过滤.
(3)粗产品中可能含有杂质离子Na+、Cl-,检验其中一种离子的方法是用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-.
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是bc(填编号).
a.热水 b.冰水 c.95%的酒精 d.四氯化碳.
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
某同学设计用物质的量之比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:

(1)在①和②的实验过程中,需要控制的关键的实验条件是控制温度,在上述晶体中,C(填“A”或“C”)应为硝酸钾晶体.
(2)在①的实验过程中,需要进行的操作依次是加水溶解、蒸发浓缩、趁热过滤.
(3)粗产品中可能含有杂质离子Na+、Cl-,检验其中一种离子的方法是用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-.
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是bc(填编号).
a.热水 b.冰水 c.95%的酒精 d.四氯化碳.
6. 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )| A. | a、c两点沉淀物成份不相同,d、e两点沉淀物成份相同 | |
| B. | b点溶液的中c(Na+)=c(C1-) | |
| C. | b-c段与c-d段溶液中阴离子的物质的量相等 | |
| D. | 在d点,向溶液中加入少量盐酸,沉淀量将减少 |
16.空气污染已成为人类社会面临的重大威胁.下列气体中,会造成空气污染的是( )
| A. | N2 | B. | O2 | C. | CO2 | D. | SO2 |
3.下列反应的离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氧化铝溶于氢氧化钠:Al2O3+2OH-═2AlO2-+H2↑ | |
| C. | 硅酸钠溶液中滴加稀盐酸:SiO32-+2H+═H2SiO3↓ | |
| D. | 澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
20.下列叙述正确的是( )
| A. | 石油的分馏、煤的干馏都是物理变化 | |
| B. | 中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥 | |
| C. | 酸碱中和滴定时,若用待测液润洗锥形瓶,将导致测定结果偏高(其他操作均正确) | |
| D. | 用铜电极电解2.0 mol•L-1的硫酸,阴阳两极生成气体的体积之比为2:1 |
1.下列说法正确的是( )
| A. | 石墨、金刚石、足球烯互为同分异构体 | |
| B. | 甲酸(HCOOH)与乙酸(CH3COOH)属于同系物 | |
| C. | 人们发现了118种元素,即共有118种原子 | |
| D. | H2和D2互为同位素 |