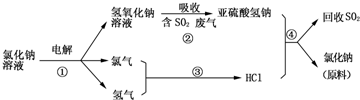
题目内容
3.下列反应的离子方程式正确的是( )| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氧化铝溶于氢氧化钠:Al2O3+2OH-═2AlO2-+H2↑ | |
| C. | 硅酸钠溶液中滴加稀盐酸:SiO32-+2H+═H2SiO3↓ | |
| D. | 澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
分析 A.电荷不守恒;
B.原子个数不守恒;
C.二者反应生成硅酸沉淀和氯化钠;
D.二氧化碳过量反应生成碳酸氢钙.
解答 解:A.用FeCl3溶液腐蚀印刷电路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.氧化铝溶于氢氧化钠,离子方程式:Al2O3+2OH-═2AlO2-+H2O,故B错误;
C.硅酸钠溶液中滴加稀盐酸,离子方程式:SiO32-+2H+═H2SiO3↓,故C正确;
D.澄清石灰水中通入过量的二氧化碳,离子方程式:OH-+CO2═HCO3-,故D错误;
故选:C.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,侧重考查复分解反应离子方程式书写,注意化学式拆分,注意原子个数、电荷守恒规律,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.已知酸性强弱顺序为H2CO3>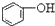 >HCO3-,下列化学方程式正确的是( )
>HCO3-,下列化学方程式正确的是( )
 >HCO3-,下列化学方程式正确的是( )
>HCO3-,下列化学方程式正确的是( )| A. | 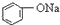 +H2O+CO2→ +H2O+CO2→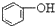 +Na2CO3 +Na2CO3 | B. | 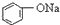 +NaHCO3→ +NaHCO3→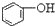 +Na2CO3 +Na2CO3 | ||
| C. | 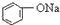 +H2O+CO2→ +H2O+CO2→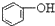 +NaHCO3 +NaHCO3 | D. | 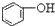 +NaHCO3→ +NaHCO3→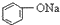 +H2O+CO2 +H2O+CO2 |
14.某无色溶液中含有K+,Cl-,OH-,SO32-,SO42-,为了检验除OH-外的其他所有阴离子,现用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,按照如下实验流程进行检验,并记录相关实验现象.下列有关结论错误的是( )


| A. | 试剂③是AgNO3溶液,试剂⑤是稀硝酸,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- | |
| D. | 试剂②是稀盐酸,试剂③是稀硝酸 |
11.填表:
| 发展阶段 | 原子结构模型 | 重要科学家 |
| 1 | 近代原子论 | |
| 2 | 汤姆生 | |
| 3 | 原子行星模型 |
18.许多国家十分重视海水资源的综合利用.不需要化学变化就能够从海水中获得的物质是( )
| A. | 溴、碘 | B. | 镁、铝 | C. | 烧碱、氢气 | D. | 食盐、淡水 |
8.5个碳的烷烃的同分异构体共有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
15.下列溶液中能大量共存的离子组是( )
| A. | 加入铝粉能产生H2的溶液:Fe2+、NH4+、SO42-、NO3- | |
| B. | 室温下水电离出c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- | |
| C. | 含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- | |
| D. | 使PH试纸呈深蓝色的溶液:Na+、K+、AlO2-、CO32- |
2.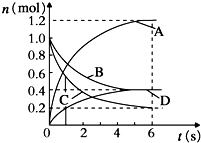 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 0~1s内,v(A)=v(c) | |
| C. | 0~6s内,B的平均反应速率为0.05mol/(L•s) | |
| D. | 0~6s内,各物质的反应速率相等 |