题目内容
19.表是四种盐在不同温度下的溶解度(g/100g水):| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
某同学设计用物质的量之比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:
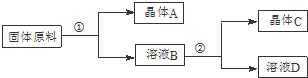
(1)在①和②的实验过程中,需要控制的关键的实验条件是控制温度,在上述晶体中,C(填“A”或“C”)应为硝酸钾晶体.
(2)在①的实验过程中,需要进行的操作依次是加水溶解、蒸发浓缩、趁热过滤.
(3)粗产品中可能含有杂质离子Na+、Cl-,检验其中一种离子的方法是用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-.
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是bc(填编号).
a.热水 b.冰水 c.95%的酒精 d.四氯化碳.
分析 由表中数据可知NaCl溶解度最小,用物质的量之比为1:1的硝酸钠和氯化钾为原料,加水溶解,由分离流程可知,在①的实验过程中,将硝酸钠和氯化钾加水溶解,蒸发浓缩,有NaCl析出,滤液B为硝酸钾,蒸发浓缩,将滤液冷却可使硝酸钾析出,以此来解答.
解答 解:由表中数据可知NaCl溶解度最小,用物质的量之比为1:1的硝酸钠和氯化钾为原料,加水溶解,由分离流程可知,在①的实验过程中,将硝酸钠和氯化钾加水溶解,蒸发浓缩,有NaCl析出,滤液B为硝酸钾,蒸发浓缩,将滤液冷却可使硝酸钾析出,
(1)硝酸钠和氯化钾不同温度下溶解度不同,控制温度可使其析出,将硝酸钠和氯化钾加水溶解,蒸发浓缩,有氯化钠析出,A为氯化钠,过滤分离出氯化钠,将滤液冷却可使硝酸钾析出,C为硝酸钾,故答案为:控制温度;C;
(2)在①的实验过程中,将硝酸钠和氯化钾加水溶解,蒸发浓缩,有氯化钠析出,趁热过滤分离出氯化钠,
故答案为:加水溶解;蒸发浓缩;趁热过滤;
(3)产品中可能仍含少量的NaCl,即Na+、Cl-;Na+利用焰色反应;Cl-用AgNO3溶液和稀硝酸检验,操作方法是用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-,
故答案为:Na+、Cl-;用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-;
(4)根据溶解度表,则硝酸钾在低温和95%的酒精溶解度表比较小,又杂质离子易溶于水和酒精溶液,所以洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是bc,故选:bc.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及流程中的混合物分离方法解答本题的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | Br2和HBrO3均是氧化产物 | |
| B. | BrF3既是氧化剂,又是还原剂 | |
| C. | BrF3的氧化性强于O2 | |
| D. | 反应中,若生成1molBr2,则反应转移6NA个电子 |
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD
A.每生成1molH-Cl键放出431.4kJ能量
B.每生成1molH-Cl键吸收431.4kJ能量
C.每拆开1molH-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考表中的数据,判断下列分子受热时最稳定的是A
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A
A、氮气的化学性质比氧气稳定
B、常温常压下,溴呈液态,碘呈固态
C、稀有气体一般很难发生化学反应
D、硝酸易挥发而硫酸难挥发.

| A. | 试剂③是AgNO3溶液,试剂⑤是稀硝酸,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- | |
| D. | 试剂②是稀盐酸,试剂③是稀硝酸 |
| A. | C2H6O | B. | C6H6 | C. | HCN | D. | CO(NH2)2 |
| 发展阶段 | 原子结构模型 | 重要科学家 |
| 1 | 近代原子论 | |
| 2 | 汤姆生 | |
| 3 | 原子行星模型 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
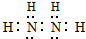 .
. HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+). )的流程:
)的流程: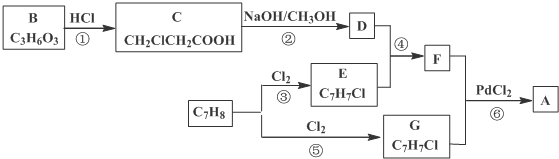
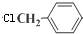
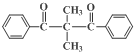 、、
、、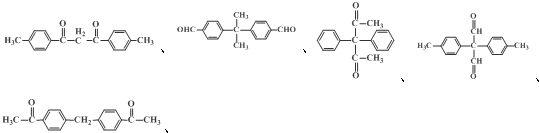 (其中两种).
(其中两种).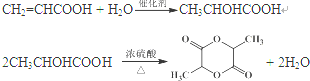 .
.