题目内容
下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A、将40gNaOH溶解于1L水中配成NaOH溶液 | ||
| B、常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | ||
C、将1L0.5mol/L的浓盐酸加热浓缩为
| ||
| D、从1000ml1mol/L的NaCl溶液中取出100ml的溶液 |
考点:物质的量浓度的相关计算
专题:
分析:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L;
B.常温常压下,22.4L HCl的物质的量不是1mol;
C.加热浓缩,HCl挥发;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等.
B.常温常压下,22.4L HCl的物质的量不是1mol;
C.加热浓缩,HCl挥发;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等.
解答:
解:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L,体积1L应是溶液体积,不是溶剂的体积,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,22.4L HCl的物质的量小于1mol,溶于水配成1L的盐酸溶液,所得溶液浓度小于1mol/L,故B错误;
C.加热浓缩,HCl挥发,盐酸浓度变稀,故C错误;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等,故D正确,
故选D.
B.常温常压下,气体摩尔体积大于22.4L/mol,22.4L HCl的物质的量小于1mol,溶于水配成1L的盐酸溶液,所得溶液浓度小于1mol/L,故B错误;
C.加热浓缩,HCl挥发,盐酸浓度变稀,故C错误;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等,故D正确,
故选D.
点评:本题考查学生对物质的量浓度的理解及有关计算,比较基础,C选项为易错点,学生容易忽略氯化氢挥发.

练习册系列答案
相关题目
室温下,下列变化后的溶液pH小于8的是( )
| A、pH=10的氨水稀释100倍 |
| B、pH=11的NaOH溶液与pH=5的盐酸等体积混合 |
| C、pH=8的NaOH溶液与pH=8的氨水等体积混合 |
| D、pH=4的醋酸和pH=10的NaOH溶液等体积混合 |
24mL浓度为0.05mol?L-1的Na2SO3溶液,恰好与20mL浓度为0.02mol?L-1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
| A、+2 | B、+3 | C、+4 | D、+5 |
美籍华裔科学家钱永健曾于2008年获得诺贝尔化学奖.16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获有“少年诺贝尔奖”之称的著名奖项.下列说法正确的是( )
| A、金属的电化学腐蚀和化学腐蚀都是金属原子失去电子而被还原的过程 |
| B、钢铁发生电化学腐蚀时,其先发生反应:Fe-3e-=Fe3+,继而形成铁锈 |
| C、减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 |
| D、金属的腐蚀会给社会带来巨大损失,所以金属的腐蚀是百害无一利的 |
在反应SiO2+3C=SiC+2CO中,氧化剂和还原剂质量之比是( )
| A、1:3 | B、3:1 |
| C、1:2 | D、2:1 |
X、Y、Z为同一短周期中的元素,其原子半径依次减小,它们的最高价氧化物对应的水化物之间,任意两种混合均可反应,M为Y、Z形成的化合物,其溶液显酸性.下列说法正确的是( )
| A、X、Y、Z简单离子的半径依次增大 |
| B、将M溶液加热蒸干并灼烧,最后可得Y的氧化物 |
| C、Y的最高价氧化物为碱性氧化物 |
| D、将少量X单质投入到M溶液中,会置换出Y单质 |
下列指定反应的离子方程式正确的是( )
| A、NaHCO3溶液中加入醋酸溶液:HCO3-+H+=CO2↑+H2O | ||
| B、NaAlO2溶液中通入过量CO2气体:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | ||
| C、Fe(OH)2溶于足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | ||
D、乙醛与含有NaOH的Cu(OH)2悬浊液共热:CH3CHO+OH-+2Cu(OH)2
|
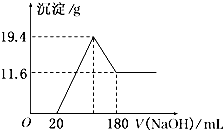 将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.
将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.