题目内容
9.下列化学方程式或离子方程式正确的是( )| A. | FeS加入稀硫酸溶液中:FeS+2H+═Fe2++H2S↑ | |
| B. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 铜片跟浓硝酸反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O | |
| D. | 酸性KMnO4溶液中滴加H2O2:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O |
分析 A.二者反应生成硫酸亚铁和硫化氢;
B.二者反应生成碳酸钙、碳酸钠和水;
C.二者反应生成硝酸铜和二氧化氮;
D.二者反应生成锰离子、氧气和水,电荷不守恒.
解答 解:A.二者反应生成硫酸亚铁和硫化氢,离子方程式为FeS+2H+═Fe2++H2S↑,故A正确;
B.二者反应生成碳酸钙、碳酸钠和水,离子方程式为2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故B错误;
C.二者反应生成硝酸铜和二氧化氮,离子方程式为Cu+2NO3-+4H+═3Cu2++2NO2↑+2H2O,故C错误;
D.二者反应生成锰离子、氧气和水,离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故D错误;
故选A.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,离子方程式的书写要遵循电荷守恒、原子守恒、转移电子守恒,注意有些化学反应还与反应物的量有关,易错选项是B.

练习册系列答案
相关题目
18.将0.2mol/L HF溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显酸性,下列关系不正确的是( )
| A. | c(HF)<c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(F-)-c(HF)=c(H+)-c(OH-) | D. | c(HF)+c(F-)=0.1mol/L |
20.4.6g纯净金属钠在干燥空气中被氧化后,得到7.0g固体,由此可判断其氧化产物是( )
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O2和Na2O | D. | 无法确定 |
17.下列叙述不正确的是( )
| A. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| B. | 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 | |
| C. | 工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止OH-移向阳极 | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 |
4.如表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题.
(1)地壳中含量最多的元素是氧;
(2)氯元素位于元素周期表第三周期ⅦA族;
(3)单质的化学性质最不活泼的是Ar;
(4)S原子结构示意图是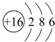 ;
;
(5)C与N原子半径较小的是N;
(6)HF和HCl中,热稳定性较强的是HF;
(7)可用来制造光导纤维的物质是SiO2(填“Si”或“SiO2”);
(8)元素最高价氧化物对应的水化物中,具有两性的是Al(OH)3(填化学式),碱性最强的是NaOH(填化学式);
(9)碳元素的最高价氧化物的化学式是CO2,其碳元素与氧元素的物质的量比n(C):n(O)=1:2.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
(2)氯元素位于元素周期表第三周期ⅦA族;
(3)单质的化学性质最不活泼的是Ar;
(4)S原子结构示意图是
 ;
;(5)C与N原子半径较小的是N;
(6)HF和HCl中,热稳定性较强的是HF;
(7)可用来制造光导纤维的物质是SiO2(填“Si”或“SiO2”);
(8)元素最高价氧化物对应的水化物中,具有两性的是Al(OH)3(填化学式),碱性最强的是NaOH(填化学式);
(9)碳元素的最高价氧化物的化学式是CO2,其碳元素与氧元素的物质的量比n(C):n(O)=1:2.
14.下列图中所示的实验操作评价合理的是( )
| A. | 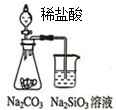 如图可能证明非金属性强弱:Cl>C>Si | |
| B. | 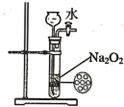 如图装置可用来制备少量氧气,并且控制反应的发生与停止 | |
| C. | 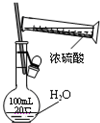 图中配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行 | |
| D. | 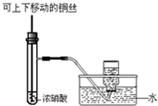 如图为制备并收集少量NO2气体 |
1.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)结论
氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为1mol/L.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为1mol/L.
