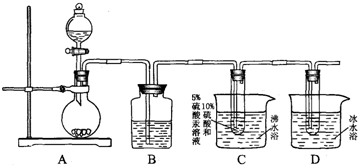
题目内容
某研究性学习小组设计了一组实验验证元素周期律.
甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象.
①甲同学设计实验的目的是 ;
②反应最剧烈的烧杯是 (填字母);
③写出b烧杯里发生反应的离子方程式 .
甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象.
①甲同学设计实验的目的是
②反应最剧烈的烧杯是
③写出b烧杯里发生反应的离子方程式
考点:性质实验方案的设计,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:①由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;
②金属性越强,单质与水反应越剧烈;
③钠与水反应生成氢氧化钠和氢气.
②金属性越强,单质与水反应越剧烈;
③钠与水反应生成氢氧化钠和氢气.
解答:
解:①由“研究性学习小组设计了一组实验验证元素周期律”可知,甲同学设计实验的目的是验证锂、钠、钾的金属性强弱;
故答案为:验证锂、钠、钾的金属性强弱;
②金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是c,
故答案为:c;
③钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑.
故答案为:验证锂、钠、钾的金属性强弱;
②金属性K>Na>Li,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是c,
故答案为:c;
③钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评:本题将元素及其化合物、元素周期律与实验知识结合起来,考查了碱金属元素性质的递变规律,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种.在此晶体中,氧离子和超氧离子的物质的量之比为( )
| A、2:1 | B、1:2 |
| C、1:1 | D、1:3 |

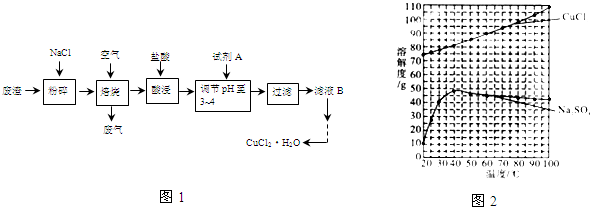
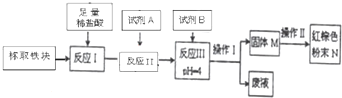
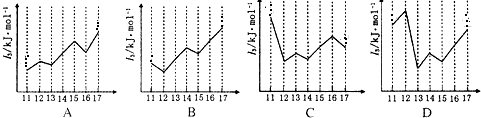

 ,则乙炔和水加成的化学方程式是
,则乙炔和水加成的化学方程式是