题目内容
铁砂的主要成分是微粒状的磁性氧化铁、石灰石等的混合物.某化学兴趣小组从铁砂中分离磁性氧化铁,并进行一系列的实验
(1)从定性角度设计实验方案,利用化学方法探究分离得到的磁性氧化铁中铁元素的价态,并填写在下表中横线空白处.
(2)取分离得到的磁性氧化铁与足量的铝粉混合进行铝热反应,取出生成的铁块(假设铁已全部被还原),并进一步测定其中铁的纯度,按以下流程进行试验: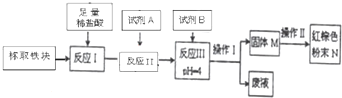
几种氢氧化物开始沉淀和沉淀完全时的PH如下表所示:
试回答:
①写出该铝热反应的化学方程式: ;
②试剂A应选择 ,反应Ⅲ中控制PH=4的目的是 ;
A、稀盐酸 B、氧化铁 C、H2O2溶液 D、氨水 E、KMnO4溶液
③操作Ⅰ的名称是 .操作Ⅱ中固体M应放在 仪器中加热.
④若称取的铁块的质量为5.0g,最终红色粉末质量为6.5g,则该铁块的纯度是 .
⑤试再设计一种测定该铁块中铁的纯度的实验方法,并简要叙述. .
(1)从定性角度设计实验方案,利用化学方法探究分离得到的磁性氧化铁中铁元素的价态,并填写在下表中横线空白处.
| 实验方案 | 实验现象与结论 |
| 取少量样品,用稀硫酸溶解后,分成两份: 一份① | ② 滴加KSCN溶液变红色,说明存在. |

几种氢氧化物开始沉淀和沉淀完全时的PH如下表所示:
| Fe(OH)2 | Fe(OH)3 | Al(OH)2 | Mg(OH)2 | |
| 开始沉淀的PH | 7.5 | 2.8 | 4.2 | 9.6 |
| 完全沉淀的PH | 9.7 | 4 | 5 | 11 |
①写出该铝热反应的化学方程式:
②试剂A应选择
A、稀盐酸 B、氧化铁 C、H2O2溶液 D、氨水 E、KMnO4溶液
③操作Ⅰ的名称是
④若称取的铁块的质量为5.0g,最终红色粉末质量为6.5g,则该铁块的纯度是
⑤试再设计一种测定该铁块中铁的纯度的实验方法,并简要叙述.
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量,铁及其化合物的性质实验
专题:实验设计题
分析:(1)磁性氧化铁为Fe3O4,可硫酸反应生成硫酸铁和硫酸亚铁,可用KMnO4溶液检验Fe2+,用KSCN检验Fe3+;
(2)①铝和四氧化三铁反应生成铁和氧化铝;
②根据题意可知,本实验要定量检测所得“铁块”的成分,故要通过实验流程,将铁元素完全沉淀;而根据表格可知,要使铁元素完全沉淀而铝和镁不沉淀,需将Fe2+转化为Fe3+,然后沉淀;
③根据操作Ⅰ需要分离出难溶物、操作Ⅱ由氢氧化铁得到氧化铁判断操作方法;
④最终红色粉末质量为6.5g,为氧化铁,可计算铁的质量,进而计算质量分数;
⑤可生成硫酸亚铁,用高锰酸钾滴定测量.
(2)①铝和四氧化三铁反应生成铁和氧化铝;
②根据题意可知,本实验要定量检测所得“铁块”的成分,故要通过实验流程,将铁元素完全沉淀;而根据表格可知,要使铁元素完全沉淀而铝和镁不沉淀,需将Fe2+转化为Fe3+,然后沉淀;
③根据操作Ⅰ需要分离出难溶物、操作Ⅱ由氢氧化铁得到氧化铁判断操作方法;
④最终红色粉末质量为6.5g,为氧化铁,可计算铁的质量,进而计算质量分数;
⑤可生成硫酸亚铁,用高锰酸钾滴定测量.
解答:
解:(1)①磁性氧化铁为Fe3O4,可硫酸反应生成硫酸铁和硫酸亚铁,可用KMnO4溶液检验Fe2+,②如酸性 KMnO4溶液褪色,可说明含有Fe2+,用KSCN检验Fe3+,
故答案为:滴加酸性 KMnO4溶液;酸性 KMnO4溶液褪色;
(2)①铝和四氧化三铁反应生成铁和氧化铝,方程式为8Al+3Fe3O4
4Al2O3+9Fe,故答案为:8Al+3Fe3O4
4Al2O3+9Fe;
②根据表格 可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,
故答案为:C;使 Fe3+离子完全沉淀,而 Al3+离子不沉淀,从而达到分离目的;
③操作Ⅰ的目的是将生成的氢氧化铁从混合液中分离,操作方法为过滤、洗涤;操作Ⅱ为将氢氧化铁转化成氧化铁,操作方法为灼烧,应在坩埚中进行,
故答案为:过滤、洗涤沉淀;坩埚;
④最终红色粉末质量为6.5g,为氧化铁,n(Fe2O3)=
=0.0406mol,m(Fe)=4.55g,ω(Fe)=
×100%=91%,故答案为:91%;
⑤本实验的方法是将铁最终转化为氧化铁,根据氧化铁的质量测量含量,也可将铁转化为亚铁离子,然后用酸性高锰酸钾滴定测量,方法是取一定质量铁块完全溶解于过量稀硫酸中,将反应后得到的溶液用一定浓度的酸性 KMnO4溶液滴定,
故答案为:取一定质量铁块完全溶解于过量稀硫酸中,将反应后得到的溶液用一定浓度的酸性 KMnO4溶液滴定.
故答案为:滴加酸性 KMnO4溶液;酸性 KMnO4溶液褪色;
(2)①铝和四氧化三铁反应生成铁和氧化铝,方程式为8Al+3Fe3O4
| ||
| ||
②根据表格 可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,
故答案为:C;使 Fe3+离子完全沉淀,而 Al3+离子不沉淀,从而达到分离目的;
③操作Ⅰ的目的是将生成的氢氧化铁从混合液中分离,操作方法为过滤、洗涤;操作Ⅱ为将氢氧化铁转化成氧化铁,操作方法为灼烧,应在坩埚中进行,
故答案为:过滤、洗涤沉淀;坩埚;
④最终红色粉末质量为6.5g,为氧化铁,n(Fe2O3)=
| 6.5g |
| 160g/mol |
| 4.55g |
| 5g |
⑤本实验的方法是将铁最终转化为氧化铁,根据氧化铁的质量测量含量,也可将铁转化为亚铁离子,然后用酸性高锰酸钾滴定测量,方法是取一定质量铁块完全溶解于过量稀硫酸中,将反应后得到的溶液用一定浓度的酸性 KMnO4溶液滴定,
故答案为:取一定质量铁块完全溶解于过量稀硫酸中,将反应后得到的溶液用一定浓度的酸性 KMnO4溶液滴定.
点评:本题考查物质的性质探究以及物质的含量测定,为高考常见题型,侧重于学生的分析、计算和实验能力的考查,注意把握实验的原理,难度中等.

练习册系列答案
相关题目
 NO3-+
NO3-+ ═
═ Fe2++
Fe2++ NH4++
NH4++
 某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成. 溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物.
