题目内容
1.乙醇和乙酸是生活中两种常见的有机物.下列说法正确的是( )| A. | 乙醇、乙酸都能与钠反应 | |
| B. | 乙醇、乙酸互为同分异构体 | |
| C. | 乙醇、乙酸都是高分子化合物 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
分析 A.乙醇含有羟基,乙酸含有羧基,都能与钠反应生成氢气;
B.乙醇、乙酸的分子式不同;
C.高分子化合物的相对分子质量一般在一万以上;
D.乙醇没有酸性,乙酸具有酸性.
解答 解:A.乙醇含有羟基,乙酸含有羧基,都能与钠反应生成氢气,故A正确;
B.二者分子式不同,不是同分异构体,故B错误;
C.乙醇和乙酸的相符分子质量较小,达不到高分子化合物的级别,不是高分子化合物,故C错误;
D.乙醇不具有酸性,不能使紫色溶液变红色,故D错误;
故选A.
点评 本题考查有机物的结构和性质,侧重于学生的分析能力的考查,为高考常见题型,注意把握有机物的官能团的性质,把握乙醇和乙酸的性质的区别,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
9.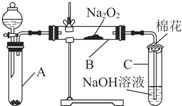 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式SO2+Na2O2=Na2SO4.
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是A中生成的SO2气体中含有水蒸气.按照乙同学的观点,该装置需做的改进是在A和B之间连接一个装有浓硫酸的洗气瓶.
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4.
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成表:
限选试剂:2mol•L-1 HCl溶液,1mol•L-1 HNO3溶液,1mol•L-1 BaCl溶液,1mol•L-1 Ba(NO3)2溶液,0.01mol•L-1 KMnO4酸性溶液.
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0mol•L-1碘水进行滴定,滴定终点现象为溶液出现蓝色,且半分钟内不褪色.记录数据,重复滴定2次,平均消耗碘水20.00mL.
②计算:生成物中亚硫酸钠的质量分数为$\frac{0.252}{a}$×100%.
 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式SO2+Na2O2=Na2SO4.
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是A中生成的SO2气体中含有水蒸气.按照乙同学的观点,该装置需做的改进是在A和B之间连接一个装有浓硫酸的洗气瓶.
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4.
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成表:
限选试剂:2mol•L-1 HCl溶液,1mol•L-1 HNO3溶液,1mol•L-1 BaCl溶液,1mol•L-1 Ba(NO3)2溶液,0.01mol•L-1 KMnO4酸性溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入1mol•L-1盐酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4, |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3;, |
| 则证明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫红色不褪去, | |
| 则说明生成物中没有Na2SO3. |
①取a g生成物配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0mol•L-1碘水进行滴定,滴定终点现象为溶液出现蓝色,且半分钟内不褪色.记录数据,重复滴定2次,平均消耗碘水20.00mL.
②计算:生成物中亚硫酸钠的质量分数为$\frac{0.252}{a}$×100%.
16.X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,X与W、Y与R分别同主族.Z在短周期元素中金属性最强,W元素原子的次外层电子数为最外层电子数的2倍,R的原子序数是Y的2倍.下列叙述错误的是( )
| A. | 原子半径:W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性强弱:R>W>X | |
| C. | Y的氢化物比R的氢化物稳定,熔沸点高 | |
| D. | Y与Z形成的两种化合物中阴、阳离子的个数比均为1:2 |
10.下列离子方程式中,正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸溶液中加入少量Ba(OH)2溶液:SO42-+Ba2+═BaSO4 | |
| C. | 用稀硫酸洗去铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硝酸汞溶液与铝反应:Hg2++Al3+═Al3++Hg |
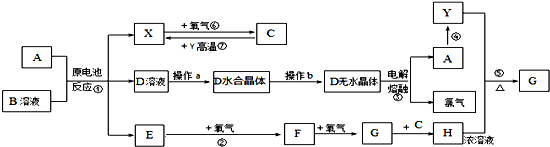
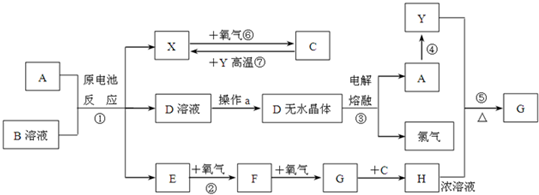
 铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题: