题目内容
11. 铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:(1)铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是铜<铁<铝(或Cu<Fe<Al).
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:2Fe3++Cu═2Fe2++Cu2+.
(3)如图装置中,铁作负极,铜电极的电极反应式为Cu2++2e-═Cu.
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其可能原因:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
(5)氯化铝广泛用作有机合成和石油工业的催化剂.将铝土矿粉(主要成分为A12O3)与焦炭混合后加热并通人氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式:Al2O3+3Cl2+3C$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO.
(6)铝与氧化铁的混合物称为铝热剂,可用于野外焊接钢轨,反应的化学方程为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
分析 (1)依据金属活动顺序表判断活泼性;
(2)铁离子具有氧化性氧化铜生成铜离子和亚铁离子;
(3)装置图是原电池装置,铁做负极是失电子生成亚铁离子,铜做正极,溶液中铜离子得到电子析出铜;
(4)在酸性条件下且加热条件下,氧气和铜、硫酸反应生成硫酸铜和水;
(5)根据反应物、生成物和反应条件写出配平反应方程式;
(6)铝与氧化铁在加热条件下反应生成氧化铝和铁.
解答 解:(1)依据金属活动顺序表得到铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是铜<铁<铝(或Cu<Fe<Al);
故答案为:铜<铁<铝(或Cu<Fe<Al);
(2)FeCl3溶液可以蚀刻铜箔,因为铁离子具有氧化性,将铜单质氧化生成铜离子和亚铁离子,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+;
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(3)装置图是原电池装置,铁做负极是失电子生成亚铁离子,Fe-2e-=Fe2+,铜做正极,溶液中铜离子得到电子析出铜,电极反应Cu2++2e-═Cu;
故答案为:负;Cu2++2e-═Cu;
(4)在酸性条件下且加热条件下,氧气和铜、硫酸反应生成硫酸铜和水,反应的化学方程式为2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(5)根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3Cl2+3C$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO,
故答案为:Al2O3+3Cl2+3C$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO;
(6)铝与氧化铁在加热条件下反应生成氧化铝和铁,反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
点评 本题考查了物质性质的分析应用,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握氧化还原反应的离子方程式和化学方程式书写,题目难度中等.

| A. | 乙醇、乙酸都能与钠反应 | |
| B. | 乙醇、乙酸互为同分异构体 | |
| C. | 乙醇、乙酸都是高分子化合物 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
| A. | 2-甲基丙烷 | B. | 环戊烷 | C. | 2,2二甲基丁烷 | D. | 2,2-甲基丙烷 |
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20 mol | D. | 大于0.20 mol,小于0.40 mol |
| A. | 12mL | B. | 15 mL | C. | 19mL | D. | 31mL |
| A. | 复分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 氧化反应 |
| A. | 同温同压下,相同体积的气体,其气体分子物质的量也相等 | |
| B. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数可能不相等 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 同温同压下,若体积不相等,则一氧化碳气体和氮气质量可能相等 |
| A. | 2,4-二甲基丁烷 | B. | 2,3,3-三甲基丁烷 | ||
| C. | 2-乙基-1-戊烯 | D. | 2,2,3-三甲基-1-戊烯 |
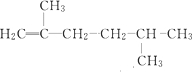 ;
;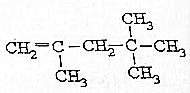
 ;
; →
→ .
.