题目内容
6.以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol•L-1)进行实验.①写出CNO-在酸性条件下被NaClO氧化的离子方程式:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为80%.
分析 ①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2),原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,据此计算.
解答 解:①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,物质的量为$\frac{1.408g}{44g/mol}$=0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为$\frac{0.032mol}{0.04mol}$×100%=80%,
故答案为:80%.
点评 本题是一道注重了化学与实际生产的联系的综合知识题,考查利用氧化还原反应来实现废水的转化,涉及实验操作,氧化还原反应等,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列根据实验现象所得出的结论中,正确的是( )
| A. | 某物质焰色反应呈黄色,结论:该物质一定是钠盐 | |
| B. | 某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,结论:原溶液一定有Fe2+ | |
| C. | 无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,结论:原溶液一定含有SO42- | |
| D. | 无色溶液中加入稀盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
17.实验室用溴化钠、浓硫酸和醇制备溴乙烷(CH3CH2Br)和1-溴丁烷(CH3CH2CH2CH2Br)的反应原理如下
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动(或提高乙醇的转化率,提高溴乙烷的产率等);但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷的沸点和正丁醇相差较小,正丁醇会随1-溴丁烷同时蒸出.
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,
1-溴丁烷在下层(填“上层”、“下层”或“不分层”),加入NaHSO3溶液的目的是除去产物中杂质溴.
(5)将实验(4)所得的1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g.NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%.(保留2位有效数字)
NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr?CH3CH2Br+H2O
CH3CH2CH2CH2OH+HBr?CH3CH2CH2CH2Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下:
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.(填字母)
a.圆底烧瓶 b.量筒 c.温度计 d.普通漏斗
(2)制备实验中常采用80%的硫酸而不用98%的浓硫酸,其主要原因是减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质.
(3)在制备溴乙烷时,采用边反应边蒸出产物的方法,这样有利于平衡向生成溴乙烷的方向移动(或提高乙醇的转化率,提高溴乙烷的产率等);但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷的沸点和正丁醇相差较小,正丁醇会随1-溴丁烷同时蒸出.
(4)将制得的1-溴丁烷粗产品置于分液漏斗中,依次加入NaHSO3溶液和水,振荡、静置后,
1-溴丁烷在下层(填“上层”、“下层”或“不分层”),加入NaHSO3溶液的目的是除去产物中杂质溴.
(5)将实验(4)所得的1-溴丁烷粗产品干燥后,进行蒸馏操作,即可得到纯净的1-溴丁烷.
(6)某实验小组在制取1-溴丁烷的实验中所取1-丁醇(CH3CH2CH2CH2OH)7.4g.NaBr13.0g,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%.(保留2位有效数字)
14.下列各项中正确的是( )
| A. |  中所有碳原子可能在同一平面上 中所有碳原子可能在同一平面上 | |
| B. | 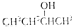 的命名为2-甲基-1-丙醇 的命名为2-甲基-1-丙醇 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | C4H8属于烯烃的同分异构体共有4种(含顺反异构) |
1.乙醇和乙酸是生活中两种常见的有机物.下列说法正确的是( )
| A. | 乙醇、乙酸都能与钠反应 | |
| B. | 乙醇、乙酸互为同分异构体 | |
| C. | 乙醇、乙酸都是高分子化合物 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
18.下列描述正确的是( )
| A. |  系统命名:2-乙基丙烷 系统命名:2-乙基丙烷 | |
| B. | 由分子式为C2H6O组成的物质一定是纯净物 | |
| C. | 正丁烷和异丁烷互为同系物 | |
| D. | 互为同系物的物质,在组成和结构上相似,所以化学性质也相似 |
15.下列叙述中正确的是( )
| A. | 碘易升华,所以碘要保存在用铁盖旋紧的试剂瓶中 | |
| B. | 液溴应保存在磨口玻璃塞试剂瓶中,并加少量水进行水封 | |
| C. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| D. | 碘易溶于酒精,所以用酒精从碘水中萃取碘 |
16.有氯气参加的化学反应一定不可能属于( )
| A. | 复分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 氧化反应 |