题目内容
7.下列有关物质制备的反应中,其原理不属于氧化还原反应的是( )| A. | 工业制粗硅 | B. | 湿法炼铜 | ||
| C. | 用稀盐酸与石灰石反应制取CO2 | D. | 稀硫酸与锌粒反应制取氢气 |
分析 发生的化学反应中,若存在元素的化合价变化,则属于氧化还原反应,反之,不存在元素的化合价变化,不属于氧化还原反应,以此来解答.
解答 解:A、工业制粗硅,发生C和二氧化硅的反应,C、Si元素的化合价变化,属于氧化还原反应,故A不选;
B、湿法冶金炼铜就是铁和硫酸铜溶液反应,生成硫酸亚铁和铜,故答案为:Fe+CuS04=Cu+FeSO4,故B不选;
C、用稀盐酸与石灰石反应制取CO2,是非氧化还原反应,故C选;
D、稀硫酸与锌粒反应制取氢气,有单质参加和生成的反应是氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高考常见题型,把握发生的化学反应及元素的化合价变化为解答的关键,注意化工生产中涉及的化学反应,题目难度不大.

练习册系列答案
相关题目
19.某海水浓缩液中含有大量的Na、Cl、Br、I(其他离子可以忽略不计),还原性:I->Br->Cl-.取1L该浓缩液,向其中通入一定量的Cl2,溶液中三种阴离子的物质的量与通人Cl2的体积(标准状况)的关系如表,下列有关说法中不正确的是( )
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
18.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是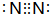 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是
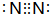 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
12.工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量盐酸中,为了除去杂质需调节溶液的pH到4,应加入的试剂是( )
| A. | NaOH | B. | NH3•H2O | C. | ZnO | D. | ZnCl2 |
16.下列离子在指定溶液中可以大量共存的是( )
| A. | 在饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | 0.1mol/L NaAlO2溶液中:K+、CO32-、SO42-、Cl- | |
| C. | 在强碱性溶液中:Na+、NH4+、SO32-、Cl- | |
| D. | 1.0mol•L-1的盐酸溶液中:K+、Fe2+、ClO-、SO42- |
17.实验室中进行粗盐提纯时,下列试剂添加过程中不符合绿色化学的是( )
| A. | BaCl2→Na2CO3 | B. | Na2CO3→HCl | C. | Na2CO3→Ca(OH)2 | D. | 水→BaCl2 |
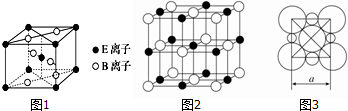
 ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.