题目内容
19.某海水浓缩液中含有大量的Na、Cl、Br、I(其他离子可以忽略不计),还原性:I->Br->Cl-.取1L该浓缩液,向其中通入一定量的Cl2,溶液中三种阴离子的物质的量与通人Cl2的体积(标准状况)的关系如表,下列有关说法中不正确的是( )| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
分析 A、2.8L氯气的物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,通入0.125mol氯气时溶液中有I-,所以Br-没有参加反应;
B、当通入Cl2的体积为2.8-5.6L时,参加反应的氯的量为:0.125mol,得电子的物质的量为0.25mol,而消耗溴离子的物质的量是0.1mol失去电子为0.1mol,所以有碘离子参加反应;
C、5.6L氯气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,通入0.25mol氯气时溶液中没有I-,则碘离子完全反应,且n(Br-)=1.4mol,说明有0.1mol溴离子参加反应,则碘离子完全反应,根据转移电子相等计算n(I-);
D、2.8L氯气的物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,通入0.125mol氯气时溶液中有I-,所以Br-没有参加反应,所以溶液中n(Br-)=1.5mol,溶液中氯离子为通入氯气生成的和原来溶液中存在的,根据Cl原子守恒得原来n(Cl-)=1.25mol-0.125mol×2=1mol;5.6L氯气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,通入0.25mol氯气时溶液中没有I-,则碘离子完全反应,且n(Br-)=1.4mol,说明有0.1mol溴离子参加反应,则碘离子完全反应,根据转移电子相等得n(I-)=0.25mol×2-0.1mol×1=0.4mol,由此分析解答.
解答 解:A、2.8L氯气的物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,通入0.125mol氯气时溶液中有I-,所以Br-没有参加反应,只有碘离子参与反应,故A正确;
B、当通入Cl2的体积为2.8-5.6L时,参加反应的氯的量为:0.125mol,得电子的物质的量为0.25mol,而消耗溴离子的物质的量是0.1mol失去电子为0.1mol,所以有碘离子参加反应,故B错误;
C、5.6L氯气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,通入2.8L氯气物质的量为0.125mol,故多通入0.125mol氯气,溶液中没有I-,则碘离子完全反应,且n(Br-)=1.4mol,说明有0.1mol溴离子参加反应,则碘离子完全反应,根据转移电子相等得n(I-)=0.125mol×2-0.1mol×1=0.15mol,所以a=0.15mol,故C正确;
D、2.8L氯气的物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,通入0.125mol氯气时溶液中有I-,所以Br-没有参加反应,所以溶液中n(Br-)=1.5mol,溶液中氯离子为通入氯气生成的和原来溶液中存在的,根据Cl原子守恒得原来n(Cl-)=1.25mol-0.125mol×2=1mol;5.6L氯气的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,通入0.25mol氯气时溶液中没有I-,则碘离子完全反应,且n(Br-)=1.4mol,说明有0.1mol溴离子参加反应,则碘离子完全反应,根据转移电子相等得n(I-)=0.25mol×2-0.1mol×1=0.4mol,通过以上分析知,n(Cl-)=1mol、n(Br-)=1.5mol、n(I-)=0.4mol,溶液体积相同,其物质的量之比等于浓度之比,所以C(Cl-):C(Br-):C(I-)=1mol:1.5mol:0.4mol=10:15:4,故D正确;
故选B.
点评 本题考查离子反应方程式的计算,明确离子反应先后顺序是解本题关键,结合转移电子守恒、原子守恒分析解答,题目难度中等.

| A. | 2-甲基-2-氯丙烷 | B. | 2-甲基-3-氯戊烷 | ||
| C. | 2,2-二甲基-1-氯丁烷 | D. | 1,3-二氯苯 |
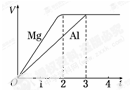 一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.下列关于反应的说法错误的是( )
一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.下列关于反应的说法错误的是( )| A. | 镁和铝的物质的量之比为3:2 | B. | 镁和铝转移电子数之比为1:3 | ||
| C. | 镁和铝的摩尔质量之比为8:9 | D. | 镁和铝反应所用时间之比为2:3 |
| A. | 反应2Mg+CO2═2MgO+C△H<0从熵变角度看,可自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8mol/L,H2CO3的Ka1=4.3×10-7mol/L,Ka2=5.6×10-11mol/L,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
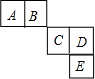 前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )
前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )| A. | 元素A、B的所有氢化物中均只含有极性共价键 | |
| B. | 元素C、D形成的简单离子的电子总数不同 | |
| C. | 元素C、D、E形成的常见单质的熔沸点大小:E>D>C | |
| D. | C、D、E三种元素最高价氧化物对应的水化物中D的酸性最强 |
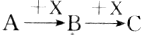 已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )| A. | SiO2 | B. | CH3CH2OH | C. | AlCl3 | D. | Cl2 |
| A. | 水银 | B. | 石墨 | C. | 硅晶体 | D. | 青铜 |
| A. | 工业制粗硅 | B. | 湿法炼铜 | ||
| C. | 用稀盐酸与石灰石反应制取CO2 | D. | 稀硫酸与锌粒反应制取氢气 |