题目内容
15.如图中每一方框表示有关的一种反应物或生成物,方框中字母是有关反应物或生成物的代号.固体A是生活中的一种常用调味品,主要来源于海水,固体B为一种淡黄色单质.现对熔融状态的A进行电解,推断并回答下列问题: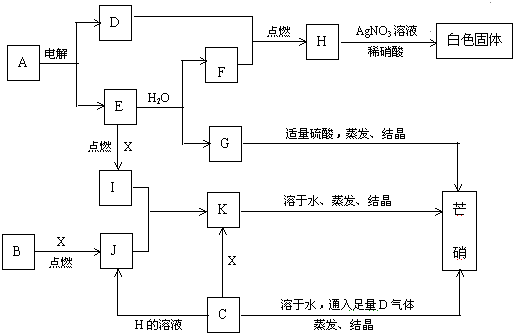
(1)E物质是Na,固体G是NaOH,芒硝的化学式是Na2SO4•10H2O.
(2)气体D和气体J均为实验室经常制备的气体,且均有毒,写出实验室制备气体J的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;以及实验室吸收有毒尾气D的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
(3)写出固体I和气体J反应生成固体K的化学方程式:Na2O2+SO2=Na2SO4;
(4)写出C的溶液与气体D反应的离子方程式:Na2SO3+Cl2+H2O=Na2SO4+2HCl.
分析 固体A是生活中的一种常用调味品,主要来源于海水,判断A为NaCl,固体B为一种淡黄色单质,判断为S,现对熔融状态的A进行电解,电解熔融氯化钠生成钠和氯气,依据转化关系分析H中含氯离子,则D为Cl2,E为Na,E和水反应生成氢氧化钠和氢气,F为H2,G为NaOH,H为HCl,G为氢氧化钠和稀硫酸反应生成硫酸钠,蒸发浓缩,冷却结晶得到硫酸钠晶体芒硝为Na2SO4•10H2O,B位S在氧气中燃烧生成SO2,E位钠在氧气中燃烧生成过氧化钠Na2O2,过氧化钠和二氧化硫反应生成K为硫酸钠,溶于水蒸发结晶得到硫酸钠晶体,转化关系中C溶于水通入足量D为Cl2,反应蒸发结晶得到硫酸钠晶体,证明C为Na2SO3,X为O2,C为Na2SO3,和H为盐酸溶液反应生成J为二氧化硫气体,据此分析判断.
解答 解:固体A是生活中的一种常用调味品,主要来源于海水,判断A为NaCl,固体B为一种淡黄色单质,判断为S,现对熔融状态的A进行电解,电解熔融氯化钠生成钠和氯气,依据转化关系分析H中含氯离子,则D为Cl2,E为Na,E和水反应生成氢氧化钠和氢气,F为H2,G为NaOH,H为HCl,G为氢氧化钠和稀硫酸反应生成硫酸钠,蒸发浓缩,冷却结晶得到硫酸钠晶体芒硝为Na2SO4•10H2O,B位S在氧气中燃烧生成SO2,E位钠在氧气中燃烧生成过氧化钠Na2O2,过氧化钠和二氧化硫反应生成K为硫酸钠,溶于水蒸发结晶得到硫酸钠晶体,转化关系中C溶于水通入足量D为Cl2,反应蒸发结晶得到硫酸钠晶体,证明C为Na2SO3,X为O2,C为Na2SO3,和H为盐酸溶液反应生成J为二氧化硫气体,
(1)上述分析可知E为Na,固体G是NaOH,芒硝的化学式是Na2SO4•10H2O,
故答案为:Na;NaOH;Na2SO4•10H2O;
(2)气体D和气体J均为实验室经常制备的气体,且均有毒,实验室制备气体J为SO2,利用亚硫酸钠固体和浓硫酸反应生成,化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,实验室吸收氯气用氢氧化钠溶液,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;Cl2+2NaOH=NaCl+NaClO+H2O;
(3)固体I和气体J反应生成固体K的反应为:Na2O2+SO2=Na2SO4,故答案为:Na2O2+SO2=Na2SO4;
(4)C的溶液与气体D反应为亚硫酸钠溶液和氯气反应生成硫酸钠和,Na2SO3+Cl2+H2O=Na2SO4+2HCl,故答案为:Na2SO3+Cl2+H2O=Na2SO4+2HCl.
点评 本题考查了无机物质的转化关系和物质性质的理解应用,主要是反应现象、反应产物的判断,掌握基础是解题关键,题目难度中等.

| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | CH3COOC2H5 (CH3COOH) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 基态碳原子的L层电子排布图: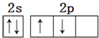 | |
| B. | 二氧化碳的电子式: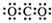 | |
| C. | 硫离子的结构示意图: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
| A. | 加入铝粉只有氢气产生的溶液中:Na+、SO42-、NO3-、Mg2+、 | |
| B. | 滴加石蕊试液显红色的溶液中:Fe3+、NH4+、Cl-、SCN- | |
| C. | 在0.1mol/L的NaHSO4溶液中:NH4+、Na+、Al3+、Cu2+、NO3- | |
| D. | 在0.1mol/L的NaHCO3溶液中K+、Al3+、Fe3+、NO3- |
| A. | HClO的结构式:H-Cl-O | B. | C(CH3)3(OH)的名称:1,1-二甲基乙醇 | ||
| C. | Na2O2的电子式: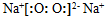 | D. | Mg2+的电子排布式:1S22S22P6 |
 ,从共用电子对是否偏移的角度,说明在H2O2中的共价键的不同之处:H、O之间极性共价键,O、O之间非极性共价键.
,从共用电子对是否偏移的角度,说明在H2O2中的共价键的不同之处:H、O之间极性共价键,O、O之间非极性共价键. ,
, ,
, ,
,