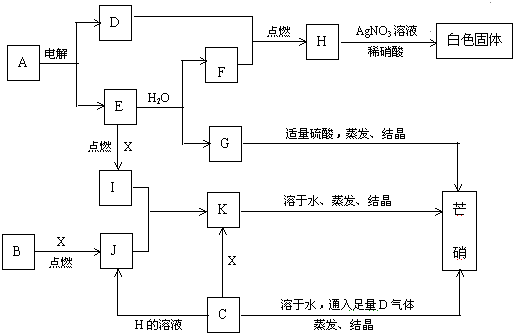
题目内容
6.下列化学用语正确的是( )| A. | 基态碳原子的L层电子排布图: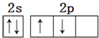 | |
| B. | 二氧化碳的电子式: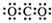 | |
| C. | 硫离子的结构示意图: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
分析 A.基态碳原子的L层有4电子,2p轨道上两个电子的自旋方向相同;
B.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
C.硫离子有18个电子,最外层电子数为8;
D.量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.基态碳原子的L层有4电子,2p轨道上两个电子的自旋方向相同,其电子排布图为 ,故A错误;
,故A错误;
B.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故B错误;
,故B错误;
C.硫离子有18个电子,最外层电子数为8,核内有16个质子,其离子结构示意图为: ,故C错误;
,故C错误;
D.元素符号左下角数字表示质子数、左上角数字表示质量数,质子数为35、中子数为45的溴原子的质量数=35+45=80,所以溴原子可以表示为:${\;}_{35}^{80}$Br,故D正确.
故选D.
点评 本题考查了化学用语的书写判断,涉及核素的表示方法、离子结构示意图、电子式等知识点,题目难度中等,根据这些化学用语特点来分析解答,注意电子排布图的书写,为易错点.

练习册系列答案
相关题目
17.在短周期元素中,属于金属元素的有( )
| A. | 13种 | B. | 9种 | C. | 5种 | D. | 3种 |
1.有机化合物Y是合成有关药物的重要中间体,可由有机化合物X经多步反应制得.

有关上述两种化合物的说法正确的是( )

有关上述两种化合物的说法正确的是( )
| A. | 1 mol X最多能与4 mol H2发生加成反应 | |
| B. | 在Y分子中只含有1个手性碳原子 | |
| C. | X、Y均可以与NaOH溶液发生反应 | |
| D. | Y能发生加成、取代、消去、水解反应 |
18.如图是模拟铁的电化学防护装置.以下叙述正确的是( )


| A. | 此装置属于电解池 | |
| B. | 此装置中的铁做正极,发生氧化反应 | |
| C. | 此装置中电子从锌极流向铁极 | |
| D. | 此装置中的锌做阴极,极反应为:Zn-2e→Zn2+ |
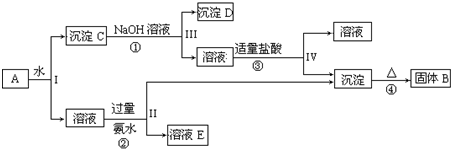
 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.